Obliczanie liczby cząsteczek wody w wypełnionej nią szklance
Gęstość wody w temperaturze 20 oC wynosi około 1 g·cm–3.
Oblicz, jaka liczba cząsteczek wody znajduje się w wypełnionej nią szklance o pojemności 250 cm3 w opisanych warunkach? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Liczba cząsteczek w próbce kwasu siarkowego(VI) o określonej objętości
W temperaturze równej 25 ⁰C bezwodny kwas siarkowy(VI) jest oleistą cieczą o gęstości około 1,83 g·cm–3.
Oblicz liczbę cząsteczek znajdujących się w próbce tego kwasu o objętości równej 5 cm3. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie minimalnej ilości wodorotlenku sodu niezbędnej do roztworzenia tlenku berylu
Tlenek berylu jest składnikiem wielu minerałów.
Oblicz minimalną masę wodorotlenku sodu, jaką powinien zawierać jego wodny roztwór użyty do całkowitego roztworzenia 3,75 g tlenku berylu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy tlenku glinu, jaką można roztworzyć wodnym roztworem zawierającym określoną ilość wodorotlenku potasu
Wiele wodorotlenków ma swoje nazwy zwyczajowe. Przykładem takiej substancji jest potaż żrący, czyli wodorotlenek potasu.
Oblicz, ile gramów tlenku glinu można przekształcić w związek kompleksowy glinu, w którym pierwiastek ten przyjmuje liczbę koordynacyjną równą 4, jeśli dysponujemy wodnym roztworem potażu żrącego zawierającym 2,8 g wodorotlenku potasu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie, czy cały tlenek miedzi(II) zostanie roztworzony
Do wodnego roztworu NaOH zawierającego 1,7 g anionów wodorotlenkowych wprowadzono 8 g tlenku miedzi(II). Zawartość naczynia ogrzano i stwierdzono przebieg reakcji chemicznej.
Ustal, czy cały tlenek miedzi(II) uległ roztworzeniu? Odpowiedź uzasadnij obliczeniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równań reakcji chemicznych wodorku niemetalu, którego wzór trzeba odszyfrować
Cząsteczki pewnego wodorku niemetalu mają budowę kątową i zawierają 5,88% wodoru. W każdej z nich są dwie niewiążące pary elektronowe, a jeden z izotopów atomu centralnego zawiera tyle samo nukleonów, co atom germanu dodatnich ładunków jądra.
Przeprowadzono dwa doświadczenia chemiczne z wykorzystaniem opisanego wodorku.
Doświadczenie nr 1: wodorek wprowadzono do wody wapiennej, w wyniku czego powstała sól obojętna.
Doświadczenie nr 2: wodorek spalono w niewielkim nadmiarze tlenu, a gazowym produktem reakcji nasycono wodę zawierającą lakmus.
Napisz równania dwóch pierwszych z opisanych reakcji chemicznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rozszyfrowanie wzoru wodorku oraz uzasadnienie odczynu roztworu powstałego z udziałem produktu spalania
Cząsteczki pewnego wodorku niemetalu mają budowę kątową i zawierają 5,88% wodoru. W każdej z nich są dwie niewiążące pary elektronowe, a jeden z izotopów atomu centralnego zawiera tyle samo nukleonów, co atom germanu dodatnich ładunków jądra.
Przeprowadzono dwa doświadczenia chemiczne z wykorzystaniem opisanego wodorku.
Doświadczenie nr 1: wodorek wprowadzono do wody wapiennej, w wyniku czego powstała sól obojętna.
Doświadczenie nr 2: wodorek spalono w niewielkim nadmiarze tlenu, a gazowym produktem reakcji nasycono wodę zawierającą lakmus.
Określ, jakie zabarwienie miał roztwór po zakończeniu doświadczenia nr 2? Odpowiedź uzasadnij równaniem odpowiedniej reakcji chemicznej zapisanym w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie wzoru sumarycznego kwasowego wodorku na podstawie wartości gęstości względnej
Wodę dejonizowaną z dodatkiem fenoloftaleiny nasycono 1,12 dm3 amoniaku. Przez uzyskany roztwór wody amoniakalnej przepuszczono 560 cm3 kwasowego wodorku, którego gęstość par względem chloru wynosi 1,83. Objętości gazów odmierzono w tych samych warunkach ciśnienia i temperatury.
Na podstawie niezbędnych obliczeń ustal wzór sumaryczny opisanego kwasowego wodorku. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej wody amoniakalnej z określoną ilością nieznanego wodorku niemetalu
Wodę dejonizowaną z dodatkiem fenoloftaleiny nasycono 1,12 dm3 amoniaku. Przez uzyskany roztwór wody amoniakalnej przepuszczono 560 cm3 kwasowego wodorku, którego gęstość par względem chloru wynosi 1,83. Objętości gazów odmierzono w tych samych warunkach ciśnienia i temperatury.
Napisz równanie reakcji chemicznej kwasowego wodorku z wodą amoniakalną, jeśli zastosowano ilości reagentów opisane w informacji wprowadzającej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór poprawnych określeń dotyczących doświadczenia z udziałem wody amoniakalnej oraz wodorku niemetalu, którego wzór trzeba odszyfrować
Wodę dejonizowaną z dodatkiem fenoloftaleiny nasycono 1,12 dm3 amoniaku. Przez uzyskany roztwór wody amoniakalnej przepuszczono 560 cm3 kwasowego wodorku, którego gęstość par względem chloru wynosi 1,83. Objętości gazów odmierzono w tych samych warunkach ciśnienia i temperatury.
Podkreśl wyrażenia w nawiasach tak, aby powstały zdania prawdziwe. Wobec fenoloftaleiny woda amoniakalna barwi się na kolor (żółty/różowy/zielony). Po przepuszczeniu przez roztwór podanej ilości kwasowego wodorku, zawartość naczynia reakcyjnego (uległa/nie uległa) odbarwieniu. Po całkowitym odparowaniu rozpuszczalnika otrzymano związek chemiczny, który jest (gazem/cieczą/ciałem stałym) o budowie (kowalencyjnej/jonowej). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór probówek, w których zaobserwowano zmiany w wyniku reakcji wodorku niemetalu, którego wzór trzeba odszyfrować
O dwóch kwasowych wodorkach niemetali wiadomo, że w tych samych warunkach gęstość ich par względem metanu wynosi 5,06. Masa molowa niemetalu w wodorku X jest mniejsza od masy molowej niemetalu w wodorku Y.
Przeprowadzono doświadczenie, którego schemat opisano poniższym rysunkiem:
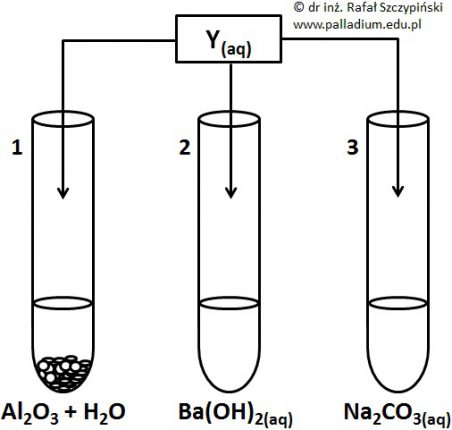
W probówce oznaczonej cyfrą 1 znajdowała się wodna zawiesina tlenku glinu. Zawartość probówek oznaczonych kolejno cyframi 2 i 3 stanowiły rozcieńczone roztwory wodne. Do każdej z probówek dodano stechiometryczną ilość rozcieńczonego wodnego roztworu wodorku Y. Podczas doświadczenia zawartość naczyń poddano wyłącznie ocenie wzrokowej.
Opisz, w których probówkach odnotowano zmiany świadczące o przebiegu reakcji chemicznej? Uzasadnij swoje stanowisko, zapisując w formie jonowej skróconej równania odpowiednich reakcji chemicznych – po jednym dla każdej z wybranych przez Ciebie probówek. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone