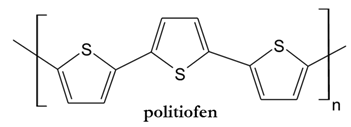
Rysowanie wzoru półstrukturalnego (grupowego) monomeru na podstawie wzoru polimeru
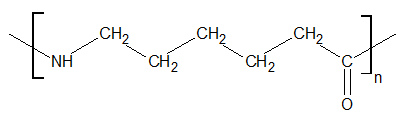
Rysunek poniżej ilustruje fragment łańcucha pewnego polimeru.
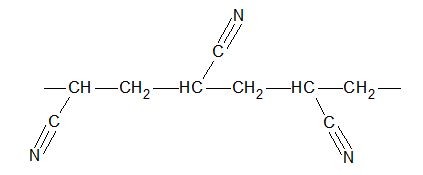
Narysuj wzór półstrukturalny (grupowy) cząsteczki jego monomeru oraz określ liczbę merów widocznych w wyżej narysowanym fragmencie cząsteczki polimeru. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy styrenu niezbędnej do otrzymania polimeru o określonej długości łańcuchów
Schemat reakcji polimeryzacji styrenu ilustruje rysunek poniżej:
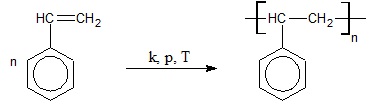
Powstały związek wielkocząsteczkowy jest ciałem stałym, którego łańcuchy polimerowe zawierają od około 3000 do 4500 merów.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
Oblicz, ile kilogramów styrenu należy poddać polimeryzacji, w celu uzyskania związku wielkocząsteczkowego o możliwie najdłuższych łańcuchach polimerowych, jeśli wydajność tego procesu wynosi 80%? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie liczb elektronów pi w określonej liczbie monomerów polistyrenu oraz określonej liczbie merów
Schemat reakcji polimeryzacji styrenu ilustruje rysunek poniżej:

Powstały związek wielkocząsteczkowy jest ciałem stałym, którego łańcuchy polimerowe zawierają od około 3000 do 4500 merów.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
Określ liczbę elektronów π znajdujących się w n merach polistyrenu oraz n cząsteczkach jego monomeru. Polistyren: Monomer: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie fragmentu cząsteczki poli(metakrylanu metylu) z dwoma widocznymi merami
Monomerem poli(metakrylanu metylu) jest pewien ester metylowy, którego cząsteczka zawiera resztę cząsteczki kwasu metakrylowego. Kwas ten stanowi najbliższy rozgałęziony homolog najprostszego nienasyconego kwasu karboksylowego.
Narysuj wzór półstrukturalny (grupowy) fragmentu cząsteczki opisanego polimeru, zawierający dwa mery i podaj nazwę systematyczną jego monomeru. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzoru grupowego cyklicznego monomeru poli(tlenku etylenu)
Poli(tlenek etylenu) jest polimerem o następującej strukturze:
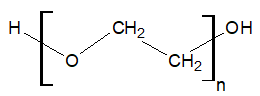
Związek ten jest przedstawicielem polieterów – związków chemicznych, w cząsteczkach których jednostki powtarzalne stanowią na przemian ułożone atomy tlenu oraz ugrupowania węglowodorowe.
Monomerem służącym do produkcji poli(tlenku etylenu) jest cykliczny związek chemiczny, w którego cząsteczkach atom tlenu łączy się wyłącznie wiązaniami sigma z atomami węgla. Narysuj wzór grupowy cząsteczki opisanego monomeru. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis wzoru sumarycznego najmniejszej jednostki powtarzalnej paraformu
Poli(tlenek etylenu) jest polimerem o następującej strukturze:

Związek ten jest przedstawicielem polieterów – związków chemicznych, w cząsteczkach których jednostki powtarzalne stanowią na przemian ułożone atomy tlenu oraz ugrupowania węglowodorowe.
Do polieterów należy również poliformaldehyd (tzw. paraform). Napisz wzór sumaryczny jego najmniejszej jednostki powtarzalnej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis wzorów sumarycznych związków chemicznych na podstawie fotografii oraz opisu doświadczenia
W dwóch różnych probówkach znajdowały się rozcieńczone roztwory – wodorotlenku potasu oraz fenolu. W celu ich odróżnienia wykorzystano roztwór pewnej substancji chemicznej wybranej spośród:
MnSO4, Br2, FeCl3, KMnO4.
Roztwór tego odczynnika oraz zawartości naczyń po zakończeniu doświadczenia ilustrują fotografie.

Napisz wzory sumaryczne – substancji, której roztwór znajduje się w probówce nr II oraz związku chemicznego, którego osad przedstawia fotografia probówki nr III. Probówka II: Probówka III: Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena z uzasadnieniem, czy produkt reakcji może zostać usunięty drogą kanalizacyjną
W dwóch różnych probówkach znajdowały się rozcieńczone roztwory – wodorotlenku potasu oraz fenolu. W celu ich odróżnienia wykorzystano roztwór pewnej substancji chemicznej wybranej spośród:
MnSO4, Br2, FeCl3, KMnO4.
Roztwór tego odczynnika oraz zawartości naczyń po zakończeniu doświadczenia ilustrują fotografie.

Na etykiecie opakowania fenolu oraz jego wielu pochodnych zamieszczane są następujące piktogramy chemiczne:

Oceń, czy uzyskany w wyniku przeprowadzonego doświadczenia produkt organiczny może zostać usunięty z laboratorium drogą kanalizacyjną. Uzasadnij odpowiedź. Ocena z uzasadnieniem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone