Miareczkowanie jest metodą stosowaną do ilościowego oznaczania zawartości substancji chemicznej w jej wodnym roztworze. Podczas jego wykonywania, do roztworu analitu o znanej objętości, lecz nieznanym stężeniu, ostrożnie wprowadzany jest znajdujący się w biurecie mianowany (o ściśle określonym stężeniu molowym) roztwór titranta. Charakterystyczny podczas miareczkowania jest tzw. punkt równoważnikowy (PR). Jest to moment, w którym analit przereagował ilościowo z dodanym z biurety titrantem. Miareczkowanie prowadzi się w obecności wskaźników kwasowo-zasadowych (indykatorów) – związków chemicznych, które zmieniają swoją barwę w zależności od pH środowiska, w jakim się znajdują. Opisana zmiana następuje w tzw. zakresie wskaźnikowym, który jest stałym zakresem wartości pH dla danego kwasowo-zasadowego indykatora. Zmiany pH miareczkowanego roztworu można zilustrować graficznie w postaci tzw. krzywej miareczkowania stanowiącej wykres zależności wartości pH analizowanego roztworu od objętości dodanego roztworu titranta.
Na podstawie: R. Szczypiński, Projektowanie doświadczeń chemicznych. Dla maturzystów i nie tylko, Warszawa 2019.
Miareczkowaniu poddano wodny roztwór propylo-1-aminy o objętości 100 cm3, a jako titrant zastosowano roztwór kwasu solnego o stężeniu 0,4 mol∙dm–3. Podczas opisanego eksperymentu punkt równoważnikowy (PR) osiągnięto przy wartości pH = 5,7. Przebieg krzywej miareczkowania sporządzonej na podstawie przeprowadzonego eksperymentu ilustruje rysunek:
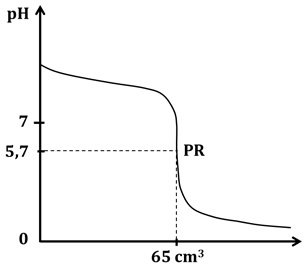
Aby zminimalizować błąd miareczkowania należy odpowiednio dobrać wskaźnik alkacymetryczny. W tabeli poniżej zebrano dane na temat zakresów pH zmiany barwy wybranych wskaźników kwasowo-zasadowych.
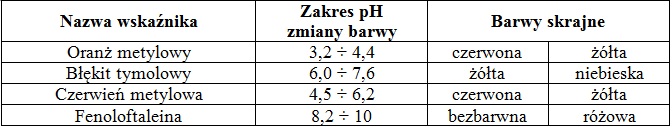
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Wybierz jeden z wyżej podanych wskaźników alkacymetrycznych, którego zastosowanie pozwoli na uzyskanie możliwie najmniejszego błędu podczas miareczkowania wodnego roztworu propylo-1-aminy w opisanym doświadczeniu. Uzasadnij swój wybór.
Nazwa wybranego wskaźnika:
Uzasadnienie:
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone