Naturalnie występujący w przyrodzie kobalt jest nuklidem zawierającym 32 neutrony. Do celów medycznych, z wykorzystaniem technik fizyki jądrowej sztucznie wytwarzany jest promieniotwórczy izotop 60Co, który nie występuje w przyrodzie. Trwałość takiego izotopu charakteryzuje wielkość zwana czasem połowicznego rozpadu (t1/2), definiowana jako czas, w którym naturalnemu rozpadowi promieniotwórczemu ulega połowa ilości początkowej radionuklidu.
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2018.
Naturalne rozpady promieniotwórcze przebiegają zgodnie z kinetyką I rzędu. Równanie kinetyczne można wówczas sprowadzić do postaci V = k·A, gdzie k oznacza stałą szybkości rozpadu promieniotwórczego oraz A – chwilową liczbę atomów promieniotwórczego pierwiastka. Dla opisanego typu przemian istnieje zależność k∙t1/2 = 0,693.
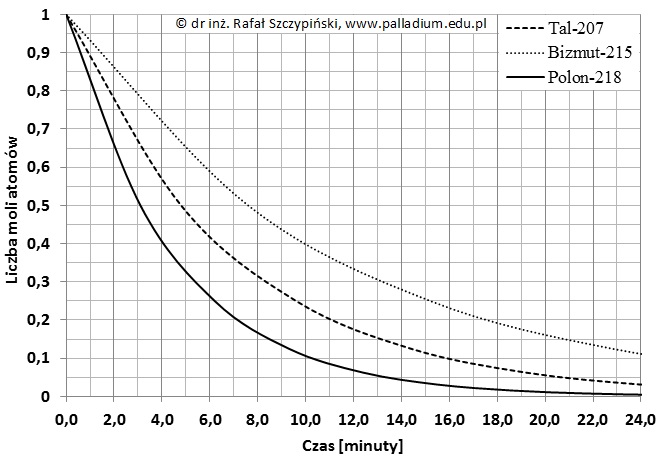
Rysunek poniżej ilustruje charakterystykę zmian liczb moli atomów trzech radioizotopów: 207Tl, 215Bi oraz 218Po w czasie 24 minut, gdy początkowa ich liczba wynosiła 1 mol.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010 oraz W. Mizerski, Tablice chemiczne, Warszawa 2013.
Podkreśl wyrażenia w nawiasach tak, aby powstały zdania prawdziwe.
Najtrwalszym wśród wymienionych trzech radionuklidów jest (207Tl / 215Bi / 218Po), dlatego wartość czasu połowicznego rozpadu tego izotopu jest (największa / najmniejsza) i wynosi około (7,6 / 3,1 / 4,8) minut. Przez pierwszych 11 minut rozpadowi ulega blisko (2,4 / 3,6 / 4,8) ∙1023 atomów izotopu talu-207, a w ciągu następnych 10 minut rozpada się około (7 / 9 / 10) ∙1022 atomów tego radionuklidu.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone