Zadanie 4. Arkusz Palladium kwiecień 2022 (1 punkt)
W tabeli zebrano informacje na temat konfiguracji elektronowych (A–D) pewnych pierwiastków chemicznych oraz jonów prostych, przy czym dana konfiguracja elektronowa może (ale nie musi) odpowiadać więcej niż jednej drobinie.
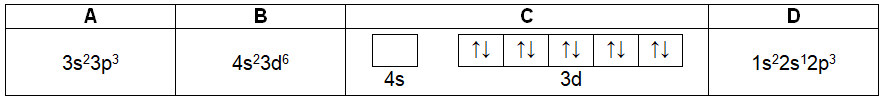
Wskaż wszystkie konfiguracje elektronowe (A, B, C, D) spełniające podane w poniższej tabeli warunki. Jeżeli dany warunek nie jest spełniony, wpisz „–”. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
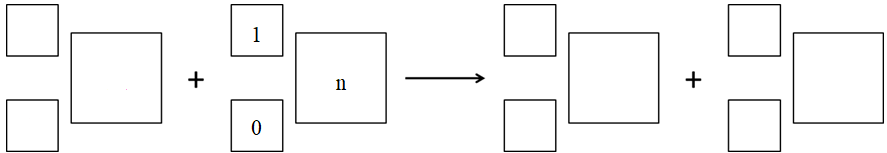
Zadanie 5. Arkusz Palladium kwiecień 2022 (1 punkt)
W temperaturze T przeprowadzono reakcję magnezu z tlenkiem węgla(IV). W wyniku opisanej przemiany powstaje główny składnik koksu oraz (jako drugi produkt) związek chemiczny zbudowany z jonów o takiej samej konfiguracji elektronowej.
Zapisz równanie reakcji chemicznej przebiegającej między magnezem i tlenkiem węgla(IV). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
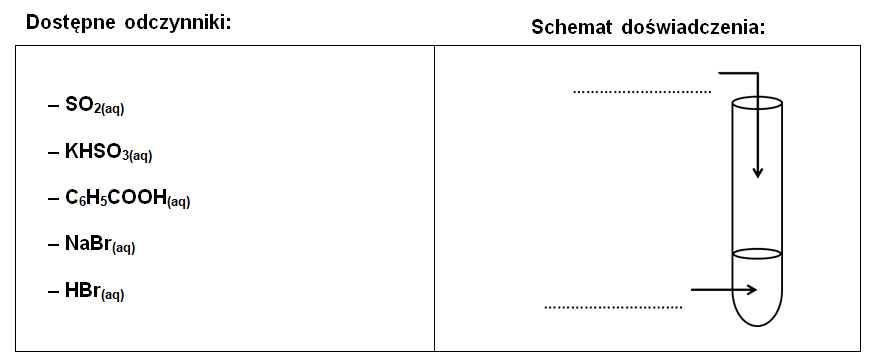
Zadanie 12.1. Arkusz Palladium kwiecień 2022 (1 punkt)
Tlenek siarki(IV) jest bezwodnikiem kwasu siarkowego(IV) o stałych dysocjacji (298 K):
Ka1 = 1,23∙10–2
Ka2 = 6,61∙10–8
Zaprojektuj doświadczenie, którego celem będzie wykazanie, że kwas siarkowy(IV) jest jednocześnie kwasem słabym oraz nietrwałym. Uzupełnij poniższy schemat doświadczenia wybierając spośród podanych odczynników te, które zostały wykorzystane do jego przeprowadzenia. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone