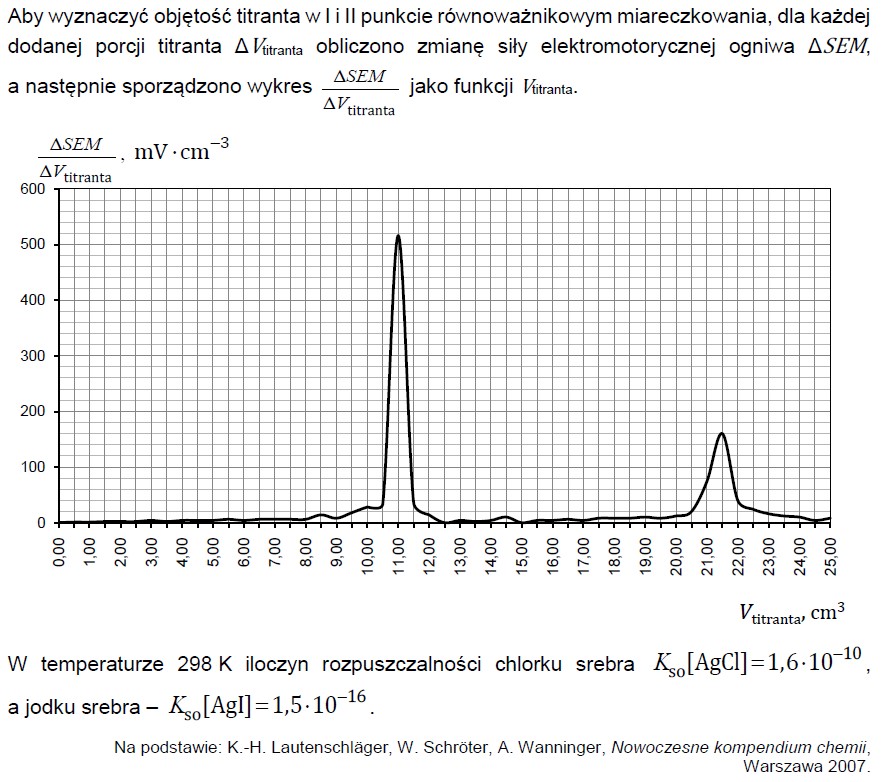
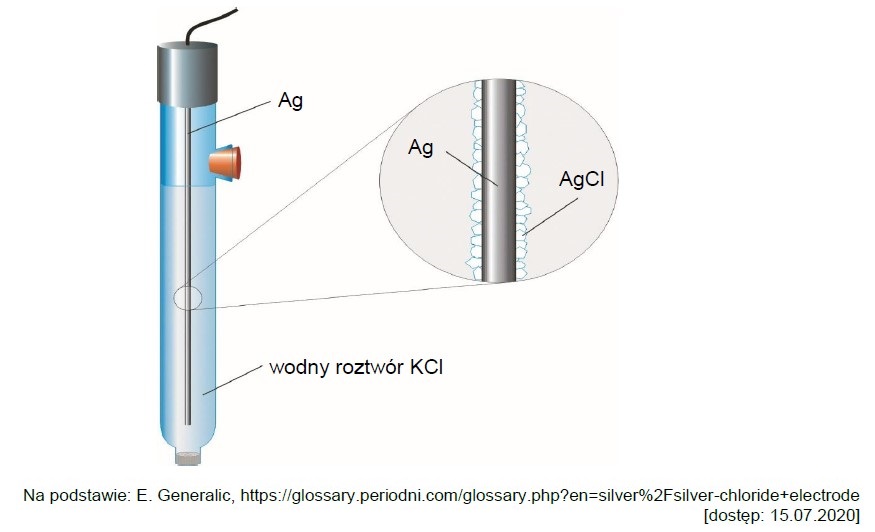
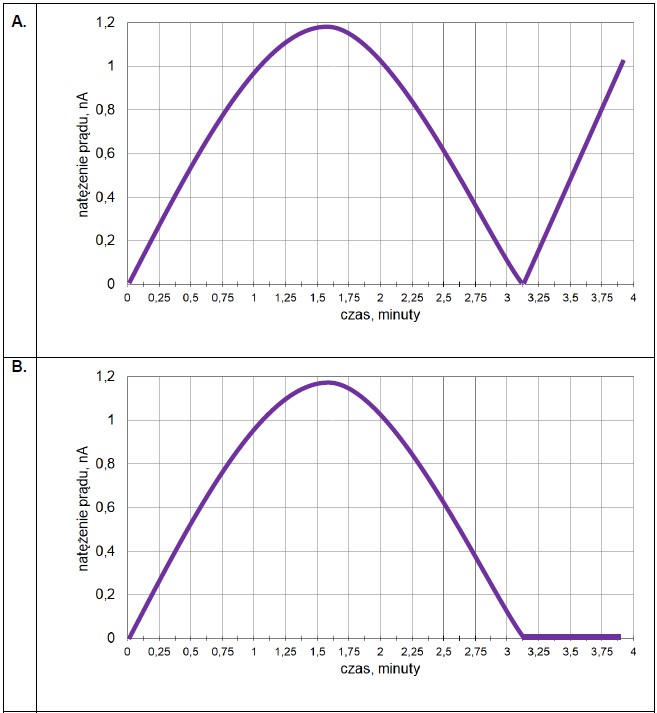
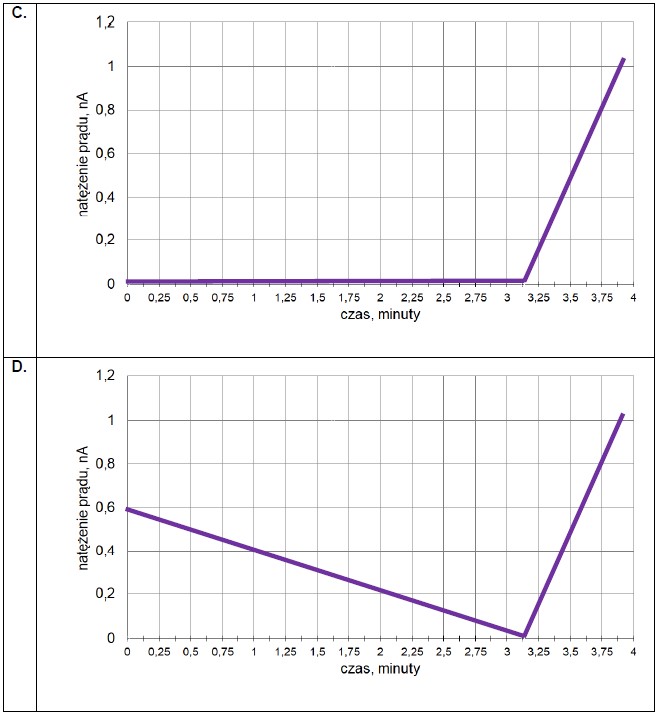
Wybór poprawnych określeń dotyczących procesu elektrolizy. Zadanie 33. Informator CKE chemia 2023 rozszerzony (1 punkt)
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w nawiasie. W procesie elektrolizy, podczas przepływu prądu przez wodny roztwór siarczanu(VI) miedzi(II) elektrony (są pobierane z katody / są przekazywane na katodę) przez kationy Cu2+. Obecne w roztworze jony miedzi(II) ulegają procesowi (redukcji / utleniania), a efektem tego jest (zwiększenie / zmniejszenie) masy katody.
Zapis równań połówkowych procesu elektrolizy w wodnych roztworach. Zadanie 34.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Przeprowadzono oddzielnie elektrolizę wodnego roztworu chlorku sodu i wodnego roztworu wodorotlenku sodu z użyciem elektrod grafitowych. W wyniku doświadczenia na elektrodach ujemnych w obu elektrolizerach otrzymano ten sam gazowy produkt. Na elektrodach dodatnich wydzielił się jeden produkt gazowy – w każdym elektrolizerze inny. Po zakończeniu elektrolizy stwierdzono, że w elektrolizerze, w którym znajdował się roztwór chlorku sodu, nastąpiła zmiana odczynu roztworu.
Napisz równania reakcji prowadzących do wydzielenia gazowego produktu na elektrodzie dodatniej podczas elektrolizy wodnego roztworu chlorku sodu (równanie 1.) i podczas elektrolizy wodnego roztworu wodorotlenku sodu (równanie 2.). 1.: 2.:
Określanie odczynu roztworu po zakończeniu elektrolizy. Zadanie 34.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
Przeprowadzono oddzielnie elektrolizę wodnego roztworu chlorku sodu i wodnego roztworu wodorotlenku sodu z użyciem elektrod grafitowych. W wyniku doświadczenia na elektrodach ujemnych w obu elektrolizerach otrzymano ten sam gazowy produkt. Na elektrodach dodatnich wydzielił się jeden produkt gazowy – w każdym elektrolizerze inny. Po zakończeniu elektrolizy stwierdzono, że w elektrolizerze, w którym znajdował się roztwór chlorku sodu, nastąpiła zmiana odczynu roztworu.
Napisz, jaki był odczyn roztworu w elektrolizerze, w którym znajdował się wodny roztwór chlorku sodu, po zakończeniu elektrolizy. Odpowiedź uzasadnij – odwołaj się do procesu zachodzącego podczas elektrolizy na elektrodzie ujemnej. Odczyn roztworu był Uzasadnienie:
Obliczanie masy glinu uzyskanego w procesie elektrolizy tlenku glinu. Zadanie 35. Informator CKE chemia 2023 rozszerzony (2 punkty)
W czasie elektrolizy stopionego tlenku glinu prowadzonej w temperaturze 2050 °C i pod ciśnieniem 1013 hPa zachodzą procesy elektrodowe zilustrowane równaniami:
Al3+ + 3ē → Al
2O2– → O2 + 4ē
Podczas tego procesu wydzielił się tlen. Objętość tlenu zmierzona w warunkach prowadzenia elektrolizy była równa 43,85 dm3.
Oblicz, ile gramów glinu otrzymano w czasie elektrolizy stopionego tlenku glinu. Przyjmij, że oba procesy elektrodowe przebiegły z wydajnością równą 100%. Uniwersalna stała gazowa R = 83,1 dm3 · hPa · mol–1 · K–1.
Zapis równań reakcji połówkowych w procesie elektrolizy zakwaszonego roztworu bromku potasu. Zadanie 39.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Heksacyjanożelazian(II) potasu to sól zawierająca kompleksowy jon o wzorze [Fe(CN)6]4–. Zawartość tego związku w badanej próbce można określić na podstawie jego reakcji ze znaną ilością bromu.
Przeprowadzono doświadczenie, którego celem było określenie liczby moli heksacyjanożelazianu(II) potasu w roztworze. Aby przygotować roztwór bromu o znanym stężeniu, zastosowano metodę elektrolitycznego wytwarzania bromu w układzie dwóch elektrod platynowych. W tym celu w zlewce umieszczono roztwór bromku potasu i kwasu siarkowego(VI) o znanym stężeniu. Następnie do tego roztworu dodano próbkę K4Fe(CN)6 o nieznanym stężeniu. W tak sporządzonym roztworze zanurzono dwie platynowe elektrody oznaczone symbolami E1 oraz E2 i przeprowadzono elektrolizę prądem o natężeniu 0,005 A. W jej wyniku wydzielił się brom, który przereagował z K4Fe(CN)6. Wydajność obu reakcji wynosiła 100%.
Napisz równania reakcji przebiegających na anodzie i na katodzie podczas opisanego procesu wytwarzania bromu. Anoda: Katoda:
Zapis równań reakcji połówkowych dla reakcji heksacyjanożelazianu(II) z bromem. Zadanie 39.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
Heksacyjanożelazian(II) potasu to sól zawierająca kompleksowy jon o wzorze [Fe(CN)6]4–. Zawartość tego związku w badanej próbce można określić na podstawie jego reakcji ze znaną ilością bromu.
Przeprowadzono doświadczenie, którego celem było określenie liczby moli heksacyjanożelazianu(II) potasu w roztworze. Aby przygotować roztwór bromu o znanym stężeniu, zastosowano metodę elektrolitycznego wytwarzania bromu w układzie dwóch elektrod platynowych. W tym celu w zlewce umieszczono roztwór bromku potasu i kwasu siarkowego(VI) o znanym stężeniu. Następnie do tego roztworu dodano próbkę K4Fe(CN)6 o nieznanym stężeniu. W tak sporządzonym roztworze zanurzono dwie platynowe elektrody oznaczone symbolami E1 oraz E2 i przeprowadzono elektrolizę prądem o natężeniu 0,005 A. W jej wyniku wydzielił się brom, który przereagował z K4Fe(CN)6. Wydajność obu reakcji wynosiła 100%.
Jon heksacyjanożelazianu(II) reaguje z bromem zgodnie ze schematem:
Br2 + Fe(CN)64– → Br– + Fe(CN)63–
Napisz w formie jonowej skróconej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania zachodzących podczas opisanej przemiany. Równanie reakcji redukcji: Równanie reakcji utlenienia:
Przyporządkowanie temperatury wrzenia do węglowodoru z uzasadnieniem. Zadanie 40. Informator CKE chemia 2023 rozszerzony (3 punkty)
Wzory trzech związków organicznych oznaczono numerami I–III i zestawiono w poniższej tabeli. Te związki różnią się wartościami temperatury wrzenia.
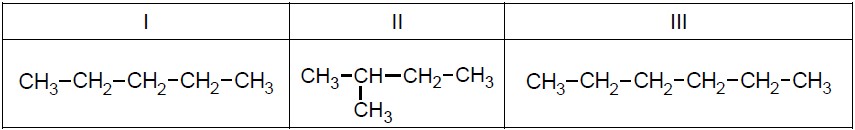
Poniżej przedstawiono – w przypadkowej kolejności – wartości temperatury wrzenia wymienionych związków (pod ciśnieniem 1013 hPa):
27,8 °C 36,1 °C 68,7 °C
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2003.
Przyporządkuj każdemu związkowi charakteryzującą go temperaturę wrzenia. Uzupełnij tabelę. Podaj nazwę systematyczną związku o najwyższej temperaturze wrzenia i nazwę systematyczną związku o najniższej temperaturze wrzenia. W obu przypadkach uzasadnij swoje przyporządkowanie. Nazwa systematyczna związku o najwyższej temperaturze wrzenia: Uzasadnienie: Nazwa systematyczna związku o najniższej temperaturze wrzenia: Uzasadnienie:
Zapis równania reakcji mononitrowania oraz nazwy jej organicznego produktu. Zadanie 43.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Dwa węglowodory aromatyczne – A i B – mają wzór sumaryczny C8H10. Izomer A w wyniku reakcji nitrowania tworzy wyłącznie jedną mononitropochodną. Izomer B poddany reakcji monochlorowania w obecności światła, a następnie – reakcji z wodnym roztworem KOH, tworzy alkohol drugorzędowy.
Napisz równanie reakcji mononitrowania związku A – zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych. Podaj nazwę systematyczną produktu mononitrowania związku A. Równanie reakcji: Nazwa systematyczna produktu mononitrowania związku A: