Zależność pH roztworu aminy od stężenia roztworu
W pewnej temperaturze T stała równowagi procesu dysocjacji elektrolitycznej etanoaminy ma wartość 5∙10–4.
Oblicz, jak zmieni się stężenie molowe roztworu tej aminy, jeśli w wyniku rozcieńczenia wodą destylowaną w temperaturze T, pH tego roztworu obniży się od wartości równej 11 do 9. Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH octu stołowego
Ocet stołowy jest 10-procentowym, wodnym roztworem kwasu etanowego, którego gęstość w temperaturze 25 ⁰C wynosi 1,02 g/cm3.
Oblicz wartość pH opisanego roztworu. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH 1-procentowego roztworu kwasu solnego
Wodny roztwór kwasu solnego o stężeniu równym 1% nie jest klasyfikowany jako substancja niebezpieczna.
Oblicz wartość pH opisanego roztworu przyjmując, że jego gęstość równa jest gęstości wody destylowanej. Wynik podaj z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH roztworu kwasu mrówkowego zawierającego określoną masę kwasu
W zlewce przygotowano 400 cm3 wodnego roztworu kwasu mrówkowego poprzez zmieszanie 9,2 g tego związku chemicznego z odpowiednią ilością wody destylowanej.
Oblicz wartość pH uzyskanego w ten sposób roztworu kwasu mrówkowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie, ile razy zmniejszyła się zawartość kwasu mrówkowego w wyniku ogrzewania jego wodnego roztworu
W zlewce przygotowano 400 cm3 wodnego roztworu kwasu mrówkowego poprzez zmieszanie 9,2 g tego związku chemicznego z odpowiednią ilością wody destylowanej.
Opisany roztwór ogrzewano w pewnych warunkach i stwierdzono, że jego objętość zmniejszyła się o 50 cm3. Po zakończeniu ogrzewania i ochłodzeniu zawartości naczynia pozostały w nim roztwór miał pH równe 2,3. Określ, wykonując niezbędne obliczenia, ile razy zmniejszyła się zawartość kwasu mrówkowego w znajdującym się w zlewce roztworze, w wyniku ogrzewania jej zawartości? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór odpowiedniego wskaźnika kwasowo-zasadowego, który barwi się na ten sam kolor w dwóch z opisanych roztworów
W tabeli zamieszczono dane na temat wybranych wskaźników kwasowo-zasadowych:
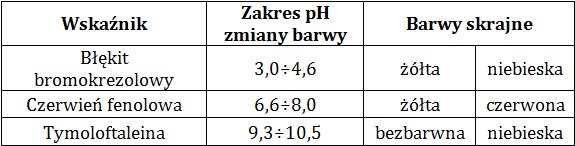
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W trzech probówkach umieszczono kolejno po 5 cm3 wodnych roztworów związków chemicznych o stężeniach:
Ba(OH)2 2·10–4 mol·dm–3, HClO2 2·10–2 mol·dm–3 oraz HClO 2·10–4 mol·dm–3.
W roztworach: wodorotlenku baru i kwasu chlorowego(I) o podanych stężeniach molowych jeden z wymienionych wskaźników kwasowo-zasadowych barwi się na ten sam kolor.
Podaj nazwę tego wskaźnika oraz barwę obu wymienionych roztworów w opisanych warunkach. Swój wybór uzasadnij obliczeniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Uzasadnienie odczynu roztworu uzyskanego w wyniku przebiegu reakcji chemicznej
W pięciu kolbach miarowych (250 cm3 każda) umieszczono 0,5-molowe, wodne roztwory następujących związków chemicznych:
1) NaOH 2) HCOOH 3) HCl 4) H2SO4 5) NH3
Napisz w formie jonowej skróconej równanie reakcji chemicznej, jaka odpowiada za odczyn wodnego roztworu uzyskanego w wyniku zmieszania równych objętości roztworów z kolb o numerach 3 i 5. Wskaż sprzężoną według teorii Brønsteda parę kwas-zasada, w podanym przez Ciebie równaniu reakcji. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia roztworu kwasu octowego na podstawie znajomości jego pH
Wodne roztwory kwasu etanowego są słabymi elektrolitami, przy czym stała równowagi reakcji dysocjacji tego kwasu ma wartość 1,8∙10–5.
Oblicz stężenie molowe roztworu kwasu etanowego o wartości pH równej 3. Wynik podaj z dokładnością do trzeciego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Przypisywanie krzywej zależności pH od stężenia kwasu odpowiedniemu roztworowi
Zmierzono wartości pH wodnych roztworów trzech kwasów oznaczonych kolejnymi literami alfabetu (A, B, C). Pomiarów dokonano w temperaturze 25 oC, w zakresie stężeń 10–6÷10–1 mol·dm–3, a wyniki eksperymentu przedstawiono w postaci graficznej.
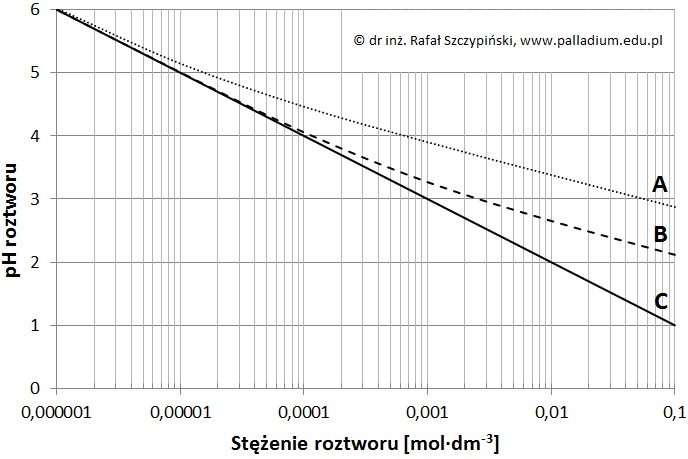
Spośród podanych niżej kwasów wybierz i przyporządkuj literom A, B i C opisującym krzywe na wykresie wzory trzech, których wodne roztwory poddano pomiarom wartości pH: C6H5OH, HBr, HF, CH3COOH. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego kwasu na podstawie odczytanej z wykresu wartości pH roztworu
Zmierzono wartości pH wodnych roztworów trzech kwasów oznaczonych kolejnymi literami alfabetu (A, B, C). Pomiarów dokonano w temperaturze 25 oC, w zakresie stężeń 10–6÷10–1 mol·dm–3, a wyniki eksperymentu przedstawiono w postaci graficznej.

Wartość pH pewnego roztworu kwasu mlekowego jest identyczna z wartością pH 0,0006-molowego roztworu najsłabszego z kwasów, których roztwory poddano pomiarom.
Podaj oznaczenie literowe (A, B lub C) kwasu o którym jest mowa, a następnie oblicz stężenie molowe roztworu kwasu mlekowego, któremu odpowiada odczytana przez Ciebie wartość pH. Wartość Ka kwasu mlekowego w temperaturze 25 oC wynosi 1,35·10–4. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH roztworu stanowiącego przesącz po reakcji strącania siarczanu(VI) baru
W kolbie o pojemności 400 cm3 umieszczono 100 cm3 roztworu chlorku baru o stężeniu 0,2 mol∙dm-3. Do zawartości naczynia wprowadzono następnie stechiometryczną ilość 0,4-molowego roztworu kwasu siarkowego(VI), co poskutkowało przebiegiem reakcji chemicznej, którą można opisać równaniem:
BaCl2 + H2SO4 ⟶ BaSO4↓ + 2HCl
Powstały osad odsączono, a przesącz ponownie umieszczono w kolbie o wyjściowej pojemności i uzupełniono wodą destylowaną do połowy pojemności naczynia.
Oblicz wartość pH uzyskanego w kolbie po zakończeniu doświadczenia roztworu. Wynik podaj z dokładnością do jednego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

