Ocena poprawności zdań dotyczących syntezy chlorowodoru. Zadanie 7. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Poniżej przedstawiono równanie syntezy chlorowodoru.
H2 (g) + Cl2 (g) ⇄ 2HCl (g)
Tę reakcję prowadzono w zamkniętym reaktorze i po pewnym czasie w układzie reakcyjnym ustaliła się równowaga.
Odczytaj w tablicy wartość standardowej molowej entalpii tworzenia HCl i oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. Podwyższenie temperatury (w warunkach izobarycznych) skutkuje wzrostem wydajności tworzenia chlorowodoru. 2. Zmiana ciśnienia (w warunkach izotermicznych) nie wpływa na wydajność tworzenia chlorowodoru.
Wskazanie liczb kationów oraz anionów w jednym molu azotku magnezu. Zadanie 10. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Azotki berylowców, o wzorze ogólnym Me3N2 (Me – atom berylowca), powstają w trakcie ogrzewania tych metali w atmosferze azotu. Są to związki o budowie jonowej składające się z kationów metali i anionów azotkowych N3–. W wyniku spalania magnezu w powietrzu powstają dwa związki o stałym stanie skupienia: tlenek magnezu i azotek magnezu. Te reakcje można opisać równaniami:
2Mg + O2 → 2MgO
3Mg + N2 → Mg3N2
Azotek magnezu reaguje z wodą zgodnie z poniższym równaniem:
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
Uzupełnij tabelę. Uwzględnij stałą Avogadra i napisz, ile kationów magnezu i anionów azotkowych znajduje się w 1 molu azotku magnezu.
Określenie rodzaju efektu energetycznego reakcji tlenku węgla(IV) z wodorem. Zadanie 8. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Reakcja tlenku węgla(IV) z wodorem przebiega zgodnie z równaniem:
CO2 (g) + H2 (g) ⇄ CO (g) + H2O (g)
W tabeli przedstawiono wartości stężeniowej stałej równowagi Kc tej reakcji w wybranych temperaturach.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Rozstrzygnij, czy reakcja tlenku węgla(IV) z wodorem jest procesem endoenergetycznym. Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Obliczenie stosunku molowego tlenku węgla(IV) do wodoru w stanie równowagi. Zadanie 9. Arkusz CKE chemia czerwiec 2024 rozszerzony (2 punkty)
Reakcja tlenku węgla(IV) z wodorem przebiega zgodnie z równaniem:
CO2 (g) + H2 (g) ⇄ CO (g) + H2O (g)
W tabeli przedstawiono wartości stężeniowej stałej równowagi Kc tej reakcji w wybranych temperaturach.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Do reaktora o stałej pojemności wprowadzono 10 moli tlenku węgla(IV) i 5,0 moli wodoru. Reaktor zamknięto i w temperaturze 800 K zainicjowano reakcję. Po pewnym czasie układ osiągnął stan równowagi.
Oblicz stosunek molowy tlenku węgla(IV) do wodoru w reaktorze po ustaleniu się stanu równowagi w temperaturze 800 K.
Obliczenie procentu masy MgO w mieszaninie. Zadanie 11. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Azotki berylowców, o wzorze ogólnym Me3N2 (Me – atom berylowca), powstają w trakcie ogrzewania tych metali w atmosferze azotu. Są to związki o budowie jonowej składające się z kationów metali i anionów azotkowych N3–. W wyniku spalania magnezu w powietrzu powstają dwa związki o stałym stanie skupienia: tlenek magnezu i azotek magnezu. Te reakcje można opisać równaniami:
2Mg + O2 → 2MgO
3Mg + N2 → Mg3N2
Azotek magnezu reaguje z wodą zgodnie z poniższym równaniem:
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
Przeprowadzono następujące doświadczenie: próbkę magnezu spalono w powietrzu i otrzymano 0,15 g mieszaniny tlenku i azotku magnezu. W reakcji tej mieszaniny z wodą wydzielił się gaz o objętości równej 4,7 cm3 w przeliczeniu na warunki normalne.
Oblicz, jaki procent masy mieszaniny tlenku i azotku magnezu stanowi MgO. Przyjmij, że reakcja wydzielania gazu zaszła z wydajnością równą 100%.
Wybór właściwych wyrazów w zdaniach dotyczących przeprowadzonego eksperymentu. Zadanie 12. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Wprowadzenie CO2 do roztworu pozostającego w równowadze z osadem węglanów powoduje ich przemianę w lepiej rozpuszczalne wodorowęglany. Stężenie CO2 w roztworze zwiększa się wraz ze wzrostem ciśnienia tego gazu w mieszaninie gazów (np. w powietrzu) nad roztworem. W tabeli przedstawiono stężenie jonów Ca2+ w roztworze pozostającym w równowadze z osadem węglanu wapnia w zależności od ciśnienia CO2 w mieszaninie gazów nad roztworem (w temperaturze 𝑇).

Na podstawie: A.M. Trzeciak, Wstęp do chemii nieorganicznej środowiska, Wrocław 1995.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Wartość pH wody, w której rozpuszcza się CO2, (rośnie / maleje). Przy wzroście ciśnienia tlenku węgla(IV) w mieszaninie gazów nad roztworem, w układzie mającym temperaturę 𝑇, od wartości 0,0 kPa do wartości 1,0 kPa następuje ok. 100-krotny (wzrost / spadek) stężenia jonów Ca2+ w wodzie.
Wybór właściwego roztworu oraz metalu. Zadanie 10. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, podczas którego dwa różne metale wprowadzono do probówek zawierających ten sam roztwór. Efekt tego doświadczenia pokazano na zdjęciach.

Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. W probówce 1. umieszczono drut wykonany z miedzi, a w probówce 2. – kawałki (cynku / srebra). Ciecz znajdująca się w obu probówkach to (wodny roztwór chlorku sodu / stężony kwas azotowy(V) / kwas solny).
Wskazanie liczby kationów magnezu oraz liczby anionów azotkowych. Zadanie 11. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Azotki berylowców, o wzorze ogólnym Me3N2 (Me – atom berylowca), powstają w trakcie ogrzewania tych metali w atmosferze azotu. Są to związki o budowie jonowej składające się z kationów metali i anionów azotkowych N3– . W wyniku spalania magnezu w powietrzu powstają dwa związki o stałym stanie skupienia: tlenek magnezu i azotek magnezu. Te reakcje można opisać równaniami:
2Mg + O2 → 2MgO
3Mg + N2 → Mg3N2
Azotek magnezu reaguje z wodą zgodnie z poniższym równaniem:
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
Uzupełnij tabelę. Uwzględnij stałą Avogadra i napisz, ile kationów magnezu i anionów azotkowych znajduje się w 1 molu azotku magnezu.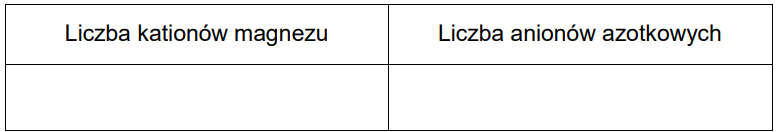
Zapis w formie jonowej równania reakcji chemicznej. Zadanie 13.1. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Wprowadzenie CO2 do roztworu pozostającego w równowadze z osadem węglanów powoduje ich przemianę w lepiej rozpuszczalne wodorowęglany. Stężenie CO2 w roztworze zwiększa się wraz ze wzrostem ciśnienia tego gazu w mieszaninie gazów (np. w powietrzu) nad roztworem. W tabeli przedstawiono stężenie jonów Ca2+ w roztworze pozostającym w równowadze z osadem węglanu wapnia w zależności od ciśnienia CO2 w mieszaninie gazów nad roztworem (w temperaturze 𝑇).

Na podstawie: A.M. Trzeciak, Wstęp do chemii nieorganicznej środowiska, Wrocław 1995.
Węglan ołowiu(II) jest białym ciałem stałym. Przeprowadzono doświadczenie, w którym do dwóch probówek dodano niewielką ilość węglanu ołowiu(II) oraz wodę i otrzymano zawiesinę.
Przez zawiesinę znajdującą się w pierwszej probówce przepuszczono CO2 i zaobserwowano zanik osadu.
Napisz w formie jonowej równanie reakcji zachodzącej w tej probówce.
Zapis w formie jonowej skróconej równania reakcji chemicznej na podstawie obserwacji. Zadanie 13.2. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (1 punkt)
Wprowadzenie CO2 do roztworu pozostającego w równowadze z osadem węglanów powoduje ich przemianę w lepiej rozpuszczalne wodorowęglany. Stężenie CO2 w roztworze zwiększa się wraz ze wzrostem ciśnienia tego gazu w mieszaninie gazów (np. w powietrzu) nad roztworem. W tabeli przedstawiono stężenie jonów Ca2+ w roztworze pozostającym w równowadze z osadem węglanu wapnia w zależności od ciśnienia CO2 w mieszaninie gazów nad roztworem (w temperaturze 𝑇).

Na podstawie: A.M. Trzeciak, Wstęp do chemii nieorganicznej środowiska, Wrocław 1995.
Węglan ołowiu(II) jest białym ciałem stałym. Przeprowadzono doświadczenie, w którym do dwóch probówek dodano niewielką ilość węglanu ołowiu(II) oraz wodę i otrzymano zawiesinę.
Do drugiej probówki dodano niewielką ilość świeżo przygotowanego wodnego roztworu KI i nie zaobserwowano żadnych zmian. Następnie przez zawiesinę znajdującą się w tej probówce przepuszczono CO2. W probówce powstał osad o żółtej barwie.
Napisz w formie jonowej skróconej równanie reakcji, która była przyczyną obserwowanych zmian.
Obliczanie procentu masy MgO w mieszaninie tlenku magnezu i azotku magnezu. Zadanie 12. Arkusz CKE chemia czerwiec 2024 rozszerzony (2 punkty)
Azotki berylowców, o wzorze ogólnym Me3N2 (Me – atom berylowca), powstają w trakcie ogrzewania tych metali w atmosferze azotu. Są to związki o budowie jonowej składające się z kationów metali i anionów azotkowych N3– . W wyniku spalania magnezu w powietrzu powstają dwa związki o stałym stanie skupienia: tlenek magnezu i azotek magnezu. Te reakcje można opisać równaniami:
2Mg + O2 → 2MgO
3Mg + N2 → Mg3N2
Azotek magnezu reaguje z wodą zgodnie z poniższym równaniem:
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
Przeprowadzono następujące doświadczenie: próbkę magnezu spalono w powietrzu i otrzymano 0,15 g mieszaniny tlenku i azotku magnezu. W reakcji tej mieszaniny z wodą wydzielił się gaz o objętości równej 4,7 cm3 w przeliczeniu na warunki normalne.
Oblicz, jaki procent masy mieszaniny tlenku i azotku magnezu stanowi MgO. Przyjmij, że reakcja wydzielania gazu zaszła z wydajnością równą 100%.
Zapis zgodnie z teorią Brønsteda równania procesu zakwaszania gleby. Zadanie 13. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Nawozy stosowane do zasilania gleby w azot mogą powodować jej zakwaszanie i nie powinny być stosowane do nawożenia gleb kwaśnych.
Spośród wymienionych poniżej związków: NaNO3 Ca(NO3)2 (NH4)2SO4 wybierz i zaznacz ten, który może spowodować dalsze zakwaszenie gleby kwaśnej. Napisz w formie jonowej równanie reakcji, której przebieg skutkuje zakwaszeniem gleby przez wybrany związek. Zastosuj definicję kwasu i zasady Brønsteda.
Obliczanie wydajności reakcji strąceniowej. Zadanie 14. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
W temperaturze 𝑇 do zlewki zawierającej 50,0 g wodnego roztworu jodku potasu o stężeniu równym 2,00 % dodano 100 cm3 wodnego roztworu azotanu(V) ołowiu(II) o stężeniu równym 0,0300 mol∙dm−3. Przebiegła reakcja wytrącania PbI2. Otrzymany osad po odsączeniu i wysuszeniu ważył 1,24 g.
Oblicz wydajność reakcji otrzymywania jodku ołowiu(II) w doświadczeniu w temperaturze T.
Wybór właściwych wyrazów w nawiasach dotyczących równowagi między osadem a roztworem nasyconym. Zadanie 14. Arkusz CKE chemia czerwiec 2024 rozszerzony (1 punkt)
Wprowadzenie CO2 do roztworu pozostającego w równowadze z osadem węglanów powoduje ich przemianę w lepiej rozpuszczalne wodorowęglany. Stężenie CO2 w roztworze zwiększa się wraz ze wzrostem ciśnienia tego gazu w mieszaninie gazów (np. w powietrzu) nad roztworem. W tabeli przedstawiono stężenie jonów Ca2+ w roztworze pozostającym w równowadze z osadem węglanu wapnia w zależności od ciśnienia CO2 w mieszaninie gazów nad roztworem (w temperaturze 𝑇).

Na podstawie: A. M. Trzeciak, Wstęp do chemii nieorganicznej środowiska, Wrocław 1995.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Wartość pH wody, w której rozpuszcza się CO2, (rośnie / maleje). Przy wzroście ciśnienia tlenku węgla(IV) w mieszaninie gazów nad roztworem, w układzie mającym temperaturę 𝑇, od wartości 0,0 kPa do wartości 1,0 kPa następuje ok. 100-krotny (wzrost / spadek) stężenia jonów Ca2+ w wodzie.
Rozstrzygnięcie dotyczące dwuczęściowego doświadczenia. Zadanie 15. Arkusz CKE chemia czerwiec 2024 rozszerzony formuła 2015 (2 punkty)
Do zlewki zawierającej wodę destylowaną dodano stały wodorotlenek magnezu. Po pewnym czasie w zlewce ustalił się stan równowagi między osadem i roztworem, czyli powstał nasycony roztwór tej substancji. Osad oddzielono od roztworu, a otrzymany przesącz umieszczono w dwóch probówkach. Do jednej probówki wprowadzono stały wodorotlenek potasu, a do drugiej – rozcieńczony kwas solny, co zilustrowano na poniższym rysunku. Podczas doświadczenia utrzymywano stałą temperaturę 𝑇.
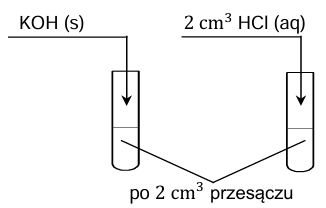
Rozstrzygnij, czy dodanie stałego wodorotlenku potasu do jednej próbki przesączu i kwasu solnego do drugiej próbki poskutkowało zmianą stężenia jonów Mg2+ w roztworze (w temperaturze T). Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Odpowiedzi uzasadnij. Dodanie stałego wodorotlenku potasu do próbki przesączu (poskutkowało zmniejszeniem / poskutkowało zwiększeniem / nie wpłynęło na wartość) stężenia jonów Mg2+ w roztworze. Uzasadnienie: Dodanie kwasu solnego do próbki przesączu (poskutkowało zmniejszeniem / poskutkowało zwiększeniem / nie wpłynęło na wartość) stężenia jonów Mg2+ w roztworze. Uzasadnienie:

