Określanie symbolu radionuklidu ulegającego rozpadowi alfa
Izotop 219At powstaje w wyniku rozpadu α pewnego radionuklidu.
Podaj symbol pierwiastka o którego radionuklidzie mowa oraz wartości opisujących go liczb – masowej (A) oraz atomowej (Z). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji jądrowej tworzenia astatu-211
Nuklidy astatu-211 otrzymać można jedynie w wyniku bombardowania cząstkami α jednego z izotopów pewnego pierwiastka chemicznego. W wyniku takiej reakcji jądrowej powstają również dwa neutrony.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Napisz równanie opisanej reakcji jądrowej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Odczyt danych ilości talu-210 z wykresu rozpadu promieniotwórczego
Rysunek poniżej przedstawia charakterystykę zmian masy izotopu talu-210 w czasie 8 minut.
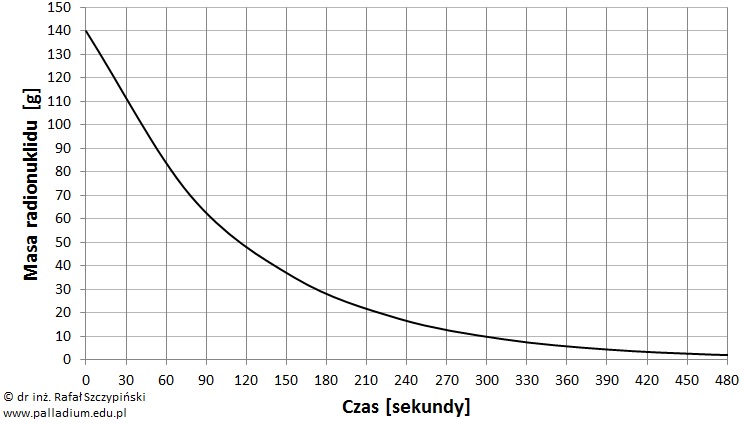
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Określ, jaka ilość tego radioizotopu rozpadła się w ciągu pierwszych 5 minut? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Odczyt czasu połowicznego rozpadu z wykresu rozpadu promieniotwórczego talu-210
Rysunek poniżej przedstawia charakterystykę zmian masy izotopu talu-210 w czasie 8 minut.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Ustal czas połowicznej przemiany (rozpadu) tego radionuklidu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wykresu rozpadu promieniotwórczego astatu-219
W ciągu 56 sekund ilość izotopu 219At zmniejsza się o połowę.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Naszkicuj wykres obrazujący charakterystykę zmian masy podanego izotopu w czasie 6,5 minuty, jeśli początkowa jego ilość była równa 1024 mg. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Początkowa ilość radioizotopu astatu-219
W ciągu 56 sekund ilość izotopu 219At zmniejsza się o połowę.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Oblicz, jaka była początkowa masa izotopu 219At, jeśli podana jego ilość w próbce, równa 80 mg ustaliła się po 224 sekundach. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie określonej masy radioizotopu z wykorzystaniem czasu połowicznej przemiany astatu-219
W ciągu 56 sekund ilość izotopu 219At zmniejsza się o połowę.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W naczyniu umieszczono próbkę zawierającą atomy nuklidu 219At, w której masa tego izotopu była równa 80 mg.
Oblicz, po ilu sekundach opisana próbka będzie zawierać 5 mg izotopu 219At? Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie czasu połowicznego rozpadu jednego z izotopów fransu
W przyrodzie frans występuje w postaci kilku radionuklidów.
Wykonując niezbędne obliczenia ustal czas połowicznego rozpadu jednego z izotopów tego pierwiastka, jeśli wiadomo, że w ciągu jednej godziny i dwudziestu ośmiu minut rozpadowi ulega 93,75% początkowej liczby atomów tego radionuklidu. Wynik podaj w minutach. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis postaci reagenta w równaniu reakcji chemicznej w odpowiedzi do zadania
Czy podczas zapisu równania reakcji jako odpowiedzi do zadania trzeba zapisywać postać, w jakiej znajdują się reagenty? Chodzi mi o zapisy (aq), (s), (c), (g), które często spotykane są w równaniach reakcji w informacji wstępnej do zadań.
TEMAT I. Wykład: stechiometria, część 1 – podstawowe zależności
Z uwagi na obszerny dział jakim jest stechiometria, temat ten został podzielony na dwa wykłady. W części pierwszej omówione zostały zagadnienia podstawowe.
Film podzielony jest na rozdziały. Możesz wybrać dowolny z nich, klikając na pasek postępu w odtwarzaczu.
0:00 Wstęp
0:28 Substraty oraz produkty – reagenty reakcji chemicznej
1:45 Podstawowe typy reakcji chemicznych – synteza, analiza, wymiana
4:01 Czym zajmuje się stechiometria?
5:30 Mol oraz liczba Avogadra
7:35 Masa molowa
10:15 Objętość molowa gazu
12:40 Powiązania matematyczne między molem, masą molową, objętością molową oraz liczbą drobin
14:00 Molowy stosunek stechiometryczny reagentów
15:10 Wagowy (masowy) stosunek stechiometryczny reagentów
18:09 Warunki normalne i stan standardowy, Równanie Clapeyrona, omówienie stałej gazowej
22:35 Prawo Boyle’a-Mariotte’a
23:43 Prawo Charles’a
24:49 Prawo Gay-Lussaca
25:44 Prawo Gay-Lussaca prawem stosunków objętościowych
28:10 Gęstość gazów
30:01 Gęstość gazu względem innego gazu
31:22 Prawo Avogadra
32:52 Prawo zachowania masy
34:55 Wydajność reakcji chemicznej
38:18 Wydajność procesu wieloetapowego
40:52 Stopień przereagowania substratów zmieszanych w stosunku stechiometrycznym
43:58 Stopień przereagowania substratów zmieszanych w stosunku niestechiometrycznym
Autorskie zadania do przećwiczenia:
Temat I – mol, masa molowa, masa substancji, liczba drobin
Temat I – objętość molowa, masa substancji, liczba drobin
Temat I – wydajność reakcji, proces wieloetapowy
Temat I – stopień przereagowania
Zadania CKE do przećwiczenia:
Czas trwania wykładu: 46 minut 27 sekund. Forma wykładu: film – prezentacja multimedialna z lektorem (Rafał Szczypiński).
TEMAT I. Wykład: stechiometria, część 2 – mieszaniny i związki chemiczne
Część druga wykładu z zakresu stechiometrii obejmuje tematykę dotyczącą mieszanin oraz związków chemicznych.
Film podzielony jest na rozdziały. Możesz wybrać dowolny z nich, klikając na pasek postępu w odtwarzaczu.
0:00 Wstęp
0:15 Pojęcie mieszaniny, przykłady mieszanin
3:09 Klasyfikacja mieszanin na jednorodne i niejednorodne
4:48 Obliczanie składu gazowej mieszaniny
6:30 Metody rozdziału mieszanin:
6:40 Siły pola magnetycznego
7:38 Sączenie
8:54 Dekantacja
11:27 Destylacja prosta
14:44 Budowa i działanie zestawu do rektyfikacji
22:21 Odparowanie rozpuszczalnika
23:36 Krystalizacja
25:06 Chromatografia płytkowa
27:38 Chromatografia kolumnowa
30:15 Ekstrakcja
32:52 Adsorpcja
34:51 Płuczka do gazów – zasada działania
37:34 Pojęcie związku chemicznego
38:35 Prawo stałości składu związku chemicznego (prawo Prousta)
40:30 Pojęcie symbolu oraz wzoru chemicznego
42:07 Rzeczywisty oraz elementarny (empiryczny) wzór chemiczny
44:40 Kreskowy oraz kropkowy wzór chemiczny
46:55 Porównanie mieszaniny ze związkiem chemicznym
Po obejrzeniu tej lekcji należy zapoznać się z artykułem:
Stosunek masowy oraz molowy składników mieszaniny – przeliczanie
Autorskie zadania do przećwiczenia:
Temat I – stechiometria wzorów chemicznych
Temat I – ustalanie wzoru empirycznego (elementarnego) oraz rzeczywistego
Temat I – ustalanie wzoru hydratu
Zadania związane z ustalaniem wzorów związków organicznych znajdziesz w poszczególnych działach zadań z chemii organicznej
Temat I – stechiometria reakcji chemicznej
Temat I – skład mieszaniny w reakcjach chemicznych
Temat I – skład mieszaniny po przerwaniu reakcji chemicznej
Zadania CKE do przećwiczenia:
Zwiastun wykładu przedstawiający jedną z metod rozdziału mieszanin znajduje się pod tym linkiem:
Czas trwania wykładu: 51 minut 29 sekund. Forma wykładu: film – prezentacja multimedialna z lektorem (Rafał Szczypiński).
Tutorial: rysowanie wzorów elektronowych cząsteczek związków chemicznych zawierających wiązanie kowalencyjne
Na filmie wyjaśniono jak poprawnie rysować wzory elektronowe kropkowe oraz kreskowe cząsteczek na przykładach kilku wybranych związków chemicznych zawierających wiązanie kowalencyjne.
Tutorial: rysowanie wzorów elektronowych cząsteczek związków chemicznych zawierających wiązanie kowalencyjne spolaryzowane
Na filmie wyjaśniono jak poprawnie rysować wzory elektronowe kropkowe oraz kreskowe cząsteczek na przykładach kilku wybranych związków chemicznych zawierających wiązanie kowalencyjne spolaryzowane.
Tutorial: rysowanie wzorów elektronowych związków chemicznych zawierających wiązanie jonowe
Na filmie wyjaśniono jak poprawnie rysować wzory elektronowe kropkowe oraz kreskowe na przykładach kilku wybranych związków chemicznych zawierających wiązanie jonowe.

