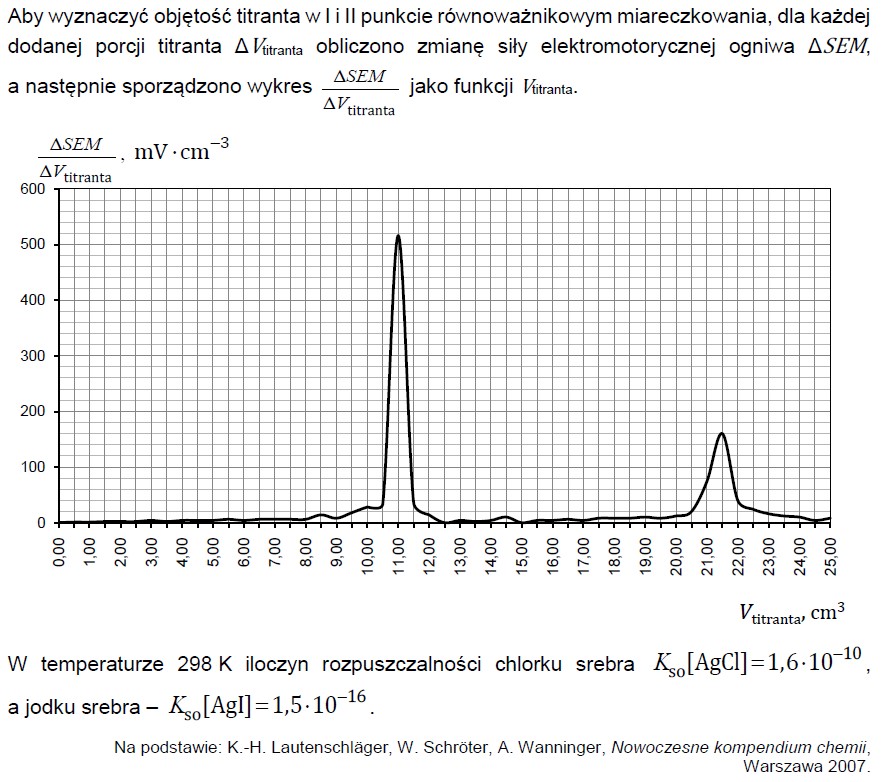
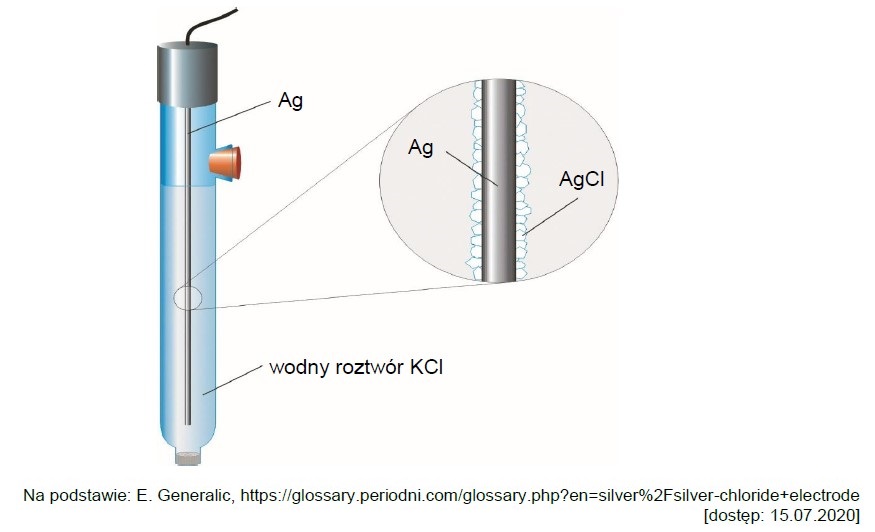
Wskazanie wzorów związków chemicznych których roztwory po zmieszaniu utworzą roztwór buforowy. Zadanie 28.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Roztwory zawierające porównywalne liczby drobin kwasu Brønsteda i sprzężonej z nim zasady nazywane są roztworami buforowymi. Przykładem buforu może być mieszanina roztworu octanu sodu i roztworu kwasu octowego. W takim roztworze ustala się równowaga chemiczna:
HA + H2O ⇄ H3O+ + A–
opisywana przez stałą dysocjacji kwasu HA.
Ponieważ
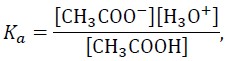
to pH buforu octanowego można z pewnym przybliżeniem obliczyć ze wzoru:
![]()
Wartość pH buforu prawie nie zależy od jego stężenia i nieznacznie się zmienia podczas dodawania niewielkich ilości mocnych kwasów lub mocnych zasad.
Zaznacz wzory dwóch związków chemicznych, których roztwory po zmieszaniu w odpowiednim stosunku pozwolą uzyskać roztwór buforowy.
HCl NaOH NH4Cl NaCl
Obliczanie pH roztworu buforowego. Zadanie 28.2. Informator CKE chemia 2023 rozszerzony (2 punkty)
Roztwory zawierające porównywalne liczby drobin kwasu Brønsteda i sprzężonej z nim zasady nazywane są roztworami buforowymi. Przykładem buforu może być mieszanina roztworu octanu sodu i roztworu kwasu octowego. W takim roztworze ustala się równowaga chemiczna:
HA + H2O ⇄ H3O+ + A–
opisywana przez stałą dysocjacji kwasu HA.
Ponieważ
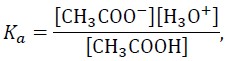
to pH buforu octanowego można z pewnym przybliżeniem obliczyć ze wzoru:
![]()
Wartość pH buforu prawie nie zależy od jego stężenia i nieznacznie się zmienia podczas dodawania niewielkich ilości mocnych kwasów lub mocnych zasad.
Zmieszano 100 cm3 roztworu octanu sodu o stężeniu 0,875 mol∙dm–3 i 400 cm3 roztworu kwasu octowego o stężeniu 0,125 mol∙dm–3. Uzyskano 500 cm3 roztworu w temperaturze 298 K.
Oblicz pH uzyskanego roztworu buforowego.
Obliczanie iloczynu rozpuszczalności wodorotlenku wapnia. Zadanie 29. Informator CKE chemia 2023 rozszerzony (2 punkty)
W kolbie umieszczono 1,0 g tlenku wapnia, dodano 100 cm3 wody, wymieszano i kolbę zamkniętą korkiem pozostawiono na kilka godzin. Następnie pobrano trochę roztworu i w temperaturze 25 °C zmierzono jego pH. Po pewnym czasie pomiar powtórzono, ale wartość pH nie zmieniła się i wynosiła 12,33. Przyjęto, że cały tlenek wapnia przereagował zgodnie z równaniem:
CaO + H2O → Ca(OH)2
i ustaliła się równowaga między fazą stałą a roztworem:
Ca(OH)2 (s) ⇄ Ca2+(aq) + 2OH–(aq)
Oblicz wartość iloczynu rozpuszczalności (Ks) wodorotlenku wapnia w warunkach doświadczenia.
Rysowanie wykresu zależności pK wody ciężkiej od temperatury. Zadanie 30. Informator CKE chemia 2023 rozszerzony (4 punkty)
Woda ciężka (tlenek deuteru, D2O), której cząsteczki zawierają deuter – izotop wodoru 2H, podobnie jak zwykła woda, ulega odwracalnemu procesowi autodysocjacji opisanemu równaniem:
2D2O ⇄ D3O+ + OD–.
Proces autodysocjacji można opisać stałą dysocjacji KD2O zależną od temperatury. Wygodnym sposobem posługiwania się stałą dysocjacji jest wyrażenie jej wartości w formie zlogarytmowanej: pKD2O= − logKD2O.
Zestawienie wartości pKD2O w różnych temperaturach podano w tabeli.
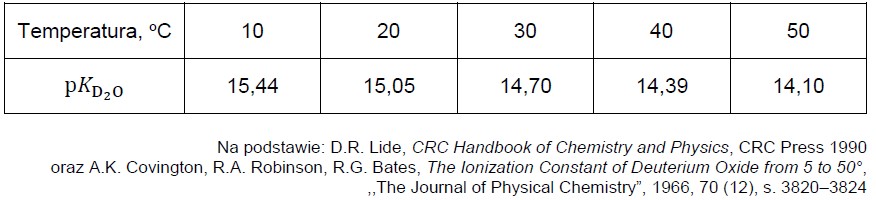
Wartość pKH2O (pKw) dla procesu autodysocjacji wody zwykłej w temperaturze 25 oC wynosi 14,00.
Narysuj wykres zależności pKD2O od temperatury i oblicz stężenie molowe jonów OD– w ciężkiej wodzie w temperaturze 25 oC. Rozstrzygnij, który proces dysocjacji – D2O czy H2O – zachodzi w większym stopniu w temperaturze 25 oC. 
Ocena poprawności zdań dotyczących ogniw chemicznych i półogniw. Zadanie 31. Informator CKE chemia 2023 rozszerzony (1 punkt)
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. W ogniwie opisanym schematem: Fe | Fe2+ || Ag+ | Ag funkcję katody pełni półogniwo żelazne, a funkcję anody – półogniwo srebrowe. 2. W pracującym ogniwie opisanym schematem: Zn | Zn2+ || Cu2+ | Cu na katodzie przebiega reakcja opisana równaniem Cu2+ + 2ē → Cu. 3. Podczas pracy ogniwa zbudowanego z półogniwa magnezowego i półogniwa ołowiowego następuje roztwarzanie magnezu i wydzielanie się ołowiu.
Obliczanie wartości SEM w określonym ogniwie chemicznym. Zadanie 32.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
W półogniwach A i B zachodzą reakcje opisane równaniami:
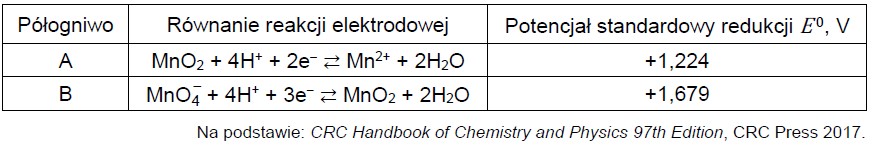
Zbudowano ogniwo z półogniw A i B.
Oblicz siłę elektromotoryczną (SEM) ogniwa zbudowanego z półogniwa A i półogniwa B w warunkach standardowych.
Zapis równania chemicznego procesu przebiegającego w ogniwie chemicznym. Zadanie 32.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
W półogniwach A i B zachodzą reakcje opisane równaniami:

Zbudowano ogniwo z półogniw A i B.
Napisz w formie jonowej skróconej sumaryczne równanie reakcji zachodzącej w ogniwie zbudowanym z półogniw A i B.
Wybór poprawnych określeń dotyczących procesu elektrolizy. Zadanie 33. Informator CKE chemia 2023 rozszerzony (1 punkt)
Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w nawiasie. W procesie elektrolizy, podczas przepływu prądu przez wodny roztwór siarczanu(VI) miedzi(II) elektrony (są pobierane z katody / są przekazywane na katodę) przez kationy Cu2+. Obecne w roztworze jony miedzi(II) ulegają procesowi (redukcji / utleniania), a efektem tego jest (zwiększenie / zmniejszenie) masy katody.
Zapis równań połówkowych procesu elektrolizy w wodnych roztworach. Zadanie 34.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Przeprowadzono oddzielnie elektrolizę wodnego roztworu chlorku sodu i wodnego roztworu wodorotlenku sodu z użyciem elektrod grafitowych. W wyniku doświadczenia na elektrodach ujemnych w obu elektrolizerach otrzymano ten sam gazowy produkt. Na elektrodach dodatnich wydzielił się jeden produkt gazowy – w każdym elektrolizerze inny. Po zakończeniu elektrolizy stwierdzono, że w elektrolizerze, w którym znajdował się roztwór chlorku sodu, nastąpiła zmiana odczynu roztworu.
Napisz równania reakcji prowadzących do wydzielenia gazowego produktu na elektrodzie dodatniej podczas elektrolizy wodnego roztworu chlorku sodu (równanie 1.) i podczas elektrolizy wodnego roztworu wodorotlenku sodu (równanie 2.). 1.: 2.:
Określanie odczynu roztworu po zakończeniu elektrolizy. Zadanie 34.2. Informator CKE chemia 2023 rozszerzony (1 punkt)
Przeprowadzono oddzielnie elektrolizę wodnego roztworu chlorku sodu i wodnego roztworu wodorotlenku sodu z użyciem elektrod grafitowych. W wyniku doświadczenia na elektrodach ujemnych w obu elektrolizerach otrzymano ten sam gazowy produkt. Na elektrodach dodatnich wydzielił się jeden produkt gazowy – w każdym elektrolizerze inny. Po zakończeniu elektrolizy stwierdzono, że w elektrolizerze, w którym znajdował się roztwór chlorku sodu, nastąpiła zmiana odczynu roztworu.
Napisz, jaki był odczyn roztworu w elektrolizerze, w którym znajdował się wodny roztwór chlorku sodu, po zakończeniu elektrolizy. Odpowiedź uzasadnij – odwołaj się do procesu zachodzącego podczas elektrolizy na elektrodzie ujemnej. Odczyn roztworu był Uzasadnienie:
Obliczanie masy glinu uzyskanego w procesie elektrolizy tlenku glinu. Zadanie 35. Informator CKE chemia 2023 rozszerzony (2 punkty)
W czasie elektrolizy stopionego tlenku glinu prowadzonej w temperaturze 2050 °C i pod ciśnieniem 1013 hPa zachodzą procesy elektrodowe zilustrowane równaniami:
Al3+ + 3ē → Al
2O2– → O2 + 4ē
Podczas tego procesu wydzielił się tlen. Objętość tlenu zmierzona w warunkach prowadzenia elektrolizy była równa 43,85 dm3.
Oblicz, ile gramów glinu otrzymano w czasie elektrolizy stopionego tlenku glinu. Przyjmij, że oba procesy elektrodowe przebiegły z wydajnością równą 100%. Uniwersalna stała gazowa R = 83,1 dm3 · hPa · mol–1 · K–1.
Zapis równań reakcji połówkowych w procesie elektrolizy zakwaszonego roztworu bromku potasu. Zadanie 39.1. Informator CKE chemia 2023 rozszerzony (1 punkt)
Heksacyjanożelazian(II) potasu to sól zawierająca kompleksowy jon o wzorze [Fe(CN)6]4–. Zawartość tego związku w badanej próbce można określić na podstawie jego reakcji ze znaną ilością bromu.
Przeprowadzono doświadczenie, którego celem było określenie liczby moli heksacyjanożelazianu(II) potasu w roztworze. Aby przygotować roztwór bromu o znanym stężeniu, zastosowano metodę elektrolitycznego wytwarzania bromu w układzie dwóch elektrod platynowych. W tym celu w zlewce umieszczono roztwór bromku potasu i kwasu siarkowego(VI) o znanym stężeniu. Następnie do tego roztworu dodano próbkę K4Fe(CN)6 o nieznanym stężeniu. W tak sporządzonym roztworze zanurzono dwie platynowe elektrody oznaczone symbolami E1 oraz E2 i przeprowadzono elektrolizę prądem o natężeniu 0,005 A. W jej wyniku wydzielił się brom, który przereagował z K4Fe(CN)6. Wydajność obu reakcji wynosiła 100%.
Napisz równania reakcji przebiegających na anodzie i na katodzie podczas opisanego procesu wytwarzania bromu. Anoda: Katoda: