Rozstrzygnięcie, czy można otrzymać roztwór o zadanym stężeniu. Zadanie 20.2. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
W tabeli zestawiono wartości (zaokrąglone do liczb całkowitych) rozpuszczalności chloranu(V) potasu w zakresie temperatury 0 oC – 100 oC.
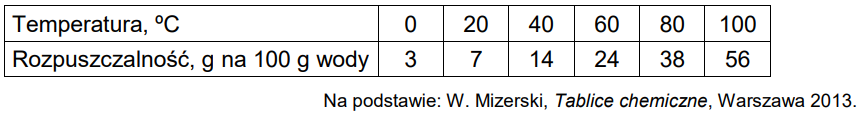
Rozstrzygnij, czy w temperaturze 20 oC można otrzymać roztwór chloranu(V) potasu o stężeniu 7% masowych. Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Odczyt temperatury w której nasycony roztwór ma określone stężenie procentowe. Zadanie 20.3. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
W tabeli zestawiono wartości (zaokrąglone do liczb całkowitych) rozpuszczalności chloranu(V) potasu w zakresie temperatury 0 oC – 100 oC.

Wykonaj obliczenia i odczytaj z wykresu wartość temperatury, w której nasycony roztwór chloranu(V) potasu ma stężenie 30% masowych. Wartość temperatury podaj w zaokrągleniu do jedności.
Zapis równania reakcji chemicznej. Zadanie 21.1. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Teflon jest odpornym termicznie i chemicznie polimerem o nazwie systematycznej poli(tetrafluoroeten). W procesie otrzymywania tego tworzywa można wyróżnić trzy etapy.
1. Trichlorometan reaguje z fluorkiem antymonu(III) SbF3 w stosunku molowym 1 : 1. W tym etapie powstają dwa produkty. Produkt organiczny tworzy się z trichlorometanu w wyniku podstawienia dwóch atomów chloru dwoma atomami fluoru.
2. Organiczny produkt powstający w etapie 1. w temperaturze 800 oC przekształca się w związek nienasycony, a produktem ubocznym tej przemiany jest chlorowodór.
3. Organiczny produkt powstający w etapie 2. w odpowiednich warunkach ulega polimeryzacji.
Napisz równanie etapu 1.
Rozstrzygnięcie, czy dany związek występuje w postaci izomerów cis-trans z uzasadnieniem. Zadanie 21.2. Arkusz CKE chemia maj 2022 rozszerzony (2 punkty)
Teflon jest odpornym termicznie i chemicznie polimerem o nazwie systematycznej poli(tetrafluoroeten). W procesie otrzymywania tego tworzywa można wyróżnić trzy etapy.
1. Trichlorometan reaguje z fluorkiem antymonu(III) SbF3 w stosunku molowym 1 : 1. W tym etapie powstają dwa produkty. Produkt organiczny tworzy się z trichlorometanu w wyniku podstawienia dwóch atomów chloru dwoma atomami fluoru.
2. Organiczny produkt powstający w etapie 1. w temperaturze 800 oC przekształca się w związek nienasycony, a produktem ubocznym tej przemiany jest chlorowodór.
3. Organiczny produkt powstający w etapie 2. w odpowiednich warunkach ulega polimeryzacji.
Rozstrzygnij, czy otrzymany związek nienasycony może występować w postaci izomerów cis – trans. Odpowiedź uzasadnij. Napisz wzór półstrukturalny (grupowy) fragmentu polimeru utworzonego z dwóch cząsteczek monomeru. Rozstrzygnięcie: Uzasadnienie: Wzór fragmentu polimeru:
Wybór właściwych słów dotyczących mieszaniny nitrującej. Zadanie 22. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Mieszanina nitrująca to mieszanina dwóch stężonych kwasów: azotowego(V) i siarkowego(VI). Między jej składnikami zachodzi reakcja, w której powstaje produkt bezpośrednio reagujący z węglowodorem aromatycznym, np. z benzenem.
Uzupełnij poniższe zdania – wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Benzen ulega reakcji substytucji (elektrofilowej / nukleofilowej / rodnikowej). Drobiny, które reagują bezpośrednio z cząsteczkami benzenu podczas nitrowania, to (rodniki ·NO2 / aniony NO2– / kationy NO2+ ).
Obliczanie procentu objętościowego etynu w mieszaninie. Zadanie 23. Arkusz CKE chemia maj 2022 rozszerzony (2 punkty)
Przygotowano roztwór bromu w dichlorometanie (rozpuszczalniku organicznym o wzorze CH2Cl2) o stężeniu 2,0% masowych. Przez płuczkę zawierającą 280 gramów opisanego roztworu bromu przepuszczano bez dostępu światła mieszaninę etanu, etenu i etynu. Podczas doświadczenia przebiegły wyłącznie reakcje zilustrowane poniższymi równaniami:
C2H2 + 2Br2 → C2H2Br4
C2H4 + Br2 → C2H4Br2
Do momentu całkowitego odbarwienia roztworu bromu przez płuczkę przepuszczono 521 cm3 mieszaniny gazów (objętość gazów podano w przeliczeniu na warunki normalne). Ustalono także, że po przejściu przez płuczkę objętość mieszaniny gazów była mniejsza o 86%.
Oblicz wyrażoną w procentach objętościowych zawartość etynu w mieszaninie zawierającej etan, eten i etyn.
Wskazanie typu oraz mechanizmu reakcji. Zadanie 24. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Poniższy schemat jest ilustracją ciągu przemian chemicznych. Substrat A to węglowodór aromatyczny, którego cząsteczki są zbudowane z siedmiu atomów węgla. W wyniku reakcji monobromowania na świetle ten węglowodór tworzy tylko jeden produkt organiczny B.
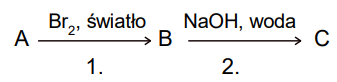
Uzupełnij poniższą tabelę. Napisz nazwę typu reakcji 1. i 2. (substytucja, addycja albo eliminacja) oraz nazwę mechanizmu (rodnikowy, nukleofilowy albo elektrofilowy), według którego przebiegają te przemiany.
Zapis cząsteczkowy równania reakcji chemicznej. Zadanie 25. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Poniższy schemat jest ilustracją ciągu przemian chemicznych. Substrat A to węglowodór aromatyczny, którego cząsteczki są zbudowane z siedmiu atomów węgla. W wyniku reakcji monobromowania na świetle ten węglowodór tworzy tylko jeden produkt organiczny B.
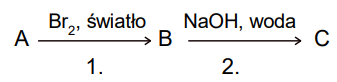
Napisz w formie cząsteczkowej równanie reakcji 2. – zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Wybór właściwych wyrazów opisujących związek chemiczny oraz aniony. Zadanie 26. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Poniższy schemat jest ilustracją ciągu przemian chemicznych. Substrat A to węglowodór aromatyczny, którego cząsteczki są zbudowane z siedmiu atomów węgla. W wyniku reakcji monobromowania na świetle ten węglowodór tworzy tylko jeden produkt organiczny B.
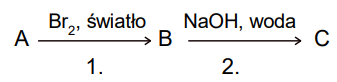
Związek C reaguje z sodem i tworzy związek D. Do probówki, w której znajdowały się kryształy związku D, dolano wodę.
Uzupełnij poniższe zdania – wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Związek D (ulega / nie ulega) hydrolizie. Anion związku D jest (słabszą / mocniejszą) zasadą niż anion wodorotlenkowy i w reakcji z wodą pełni funkcję (kwasu / zasady) Brønsteda.
Wskazanie właściwej nazwy kwasu z którego powstał lakton. Zadanie 27. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Estry cykliczne powstają w reakcjach wewnątrzcząsteczkowej lub międzycząsteczkowej estryfikacji kwasów karboksylowych, których cząsteczki mają dwie grupy funkcyjne: karboksylową i hydroksylową. Powstałe wiązanie estrowe jest fragmentem pierścienia. W wyniku reakcji wewnątrzcząsteczkowej estryfikacji pewnego hydroksykwasu otrzymano związek o wzorze przedstawionym poniżej.
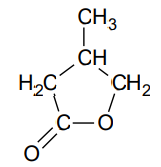
Dokończ zdanie. Zaznacz właściwą odpowiedź spośród podanych. Kwas, z którego otrzymano związek o podanym wzorze, to A. kwas 3-hydroksy-3-metylobutanowy. B. kwas 4-hydroksy-2-metylobutanowy. C. kwas 4-hydroksy-3-metylobutanowy. D. kwas 3-hydroksy-4-metylobutanowy.
Zapis wzorów produktów utleniania homologów benzenu zakwaszonym roztworem manganianu(VII) potasu. Zadanie 28. Arkusz CKE chemia maj 2022 rozszerzony (2 punkty)
Benzen wykazuje całkowitą odporność na działanie wodnego roztworu KMnO4, ale grupy alkilowe przy pierścieniu benzenowym są podatne na utlenianie. Każda grupa alkilowa ulega utlenieniu aż do momentu, gdy powstanie z niej grupa karboksylowa związana bezpośrednio z pierścieniem aromatycznym.
Na podstawie: J. McMurry, Chemia organiczna, Warszawa 2000.
Uzupełnij poniższe schematy. Napisz wzory półstrukturalne (grupowe) lub uproszczone kwasów karboksylowych powstających w wyniku całkowitego utlenienia poniższych związków roztworem KMnO4.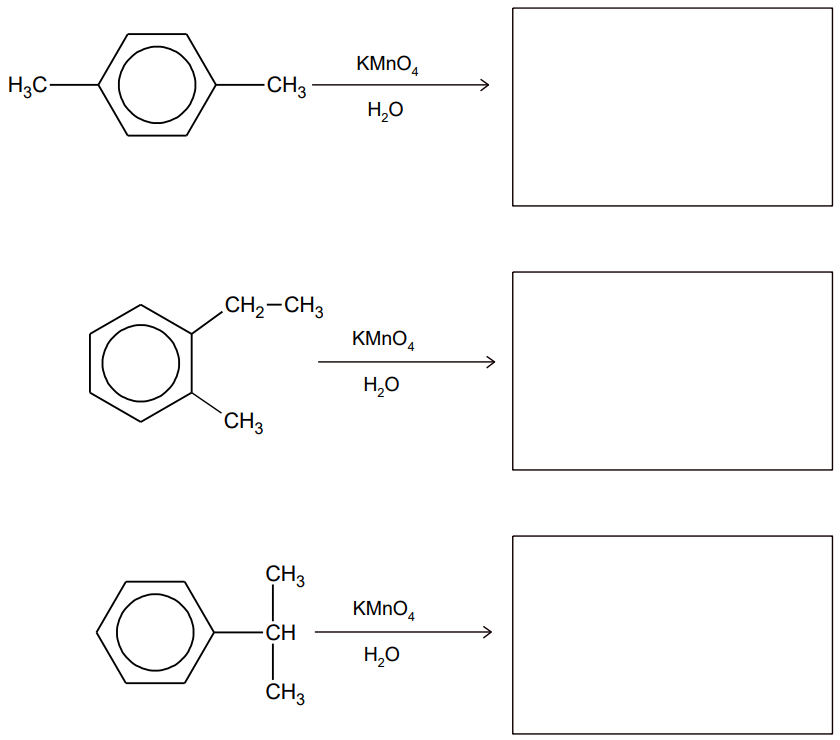
Zapis sekwencji aminokwasów analizowanego pentapeptydu. Zadanie 29. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Sekwencję aminokwasów w peptydach przedstawia się najczęściej za pomocą trzyliterowych kodów aminokwasów. W tej notacji z lewej strony umieszcza się kod aminokwasu, którego reszta zawiera wolną grupę aminową połączoną z atomem węgla α (tzw. N-koniec). Analiza składu pewnego pentapeptydu wykazuje, że powstał on z pięciu różnych aminokwasów. Cztery z aminokwasów, które zidentyfikowano podczas analizy, to: Gly, Cys, Phe, Leu. Piąty aminokwas, którego nie udało się zidentyfikować, oznaczono jako Xxx. Ustalono ponadto, że ten aminokwas stanowi N-koniec peptydu. Podczas częściowej hydrolizy badanego pentapeptydu otrzymano następujące peptydy:
Cys-Leu-Phe Gly-Cys-Leu Xxx-Gly Leu-Phe
Napisz sekwencję aminokwasów analizowanego pentapeptydu. Zastosuj oznaczenie Xxx niezidentyfikowanego aminokwasu.
Uzupełnienie schematu syntezy teaniny. Zadanie 31. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Teanina jest aminokwasem występującym np. w zielonej herbacie. Punkt izoelektryczny teaniny jest równy 5,6. Substratem do syntezy teaniny jest pewien aminokwas białkowy, który w etapie I ulega dekarboksylacji do aminy X. W etapie II ta amina ulega kondensacji z kwasem glutaminowym i powstaje wiązanie peptydowe (amidowe). Udział w reakcji bierze grupa karboksylowa znajdująca się w łańcuchu bocznym kwasu glutaminowego.
Uzupełnij schemat syntezy teaniny. Wpisz wzory półstrukturalne (grupowe) aminokwasu oraz aminy X.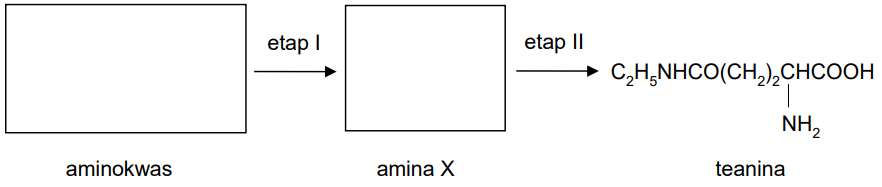
Wybór właściwego wyrazu dotyczącego doświadczenia z udziałem teaniny. Zadanie 32. Arkusz CKE chemia maj 2022 rozszerzony (1 punkt)
Teanina jest aminokwasem występującym np. w zielonej herbacie. Punkt izoelektryczny teaniny jest równy 5,6. Substratem do syntezy teaniny jest pewien aminokwas białkowy, który w etapie I ulega dekarboksylacji do aminy X. W etapie II ta amina ulega kondensacji z kwasem glutaminowym i powstaje wiązanie peptydowe (amidowe). Udział w reakcji bierze grupa karboksylowa znajdująca się w łańcuchu bocznym kwasu glutaminowego.
W zależności od pH teanina występuje w postaci kationów, anionów lub jonów obojnaczych. Wykonano doświadczenie, w którym do wodnego roztworu teaniny o pH = 5,6 dodano kwas solny i otrzymano roztwór o pH = 2. W wyniku zachodzącej reakcji zmieniły się stężenia jonów teaniny.
Uzupełnij poniższe zdanie – wybierz i zaznacz jedną odpowiedź spośród podanych w nawiasie. Podczas opisanego doświadczenia wzrosło stężenie (anionów / kationów / jonów obojnaczych) teaniny.