Te zadania pojawiły się na maturze (kwasy karboksylowe)
2025:
Zadanie 20, Zadanie 23, Zadanie 26, Zadanie 28.1
2024:
Zadanie 21.1, Zadanie 21.2, Zadanie 22, Zadanie 20.1, Zadanie 20.2, Zadanie 22, Zadanie 25, Zadanie 26
2023:
Zadanie 29, Zadanie 30, Zadanie 31, Zadanie 32
2022:
2021:
2019:
2017:
Zadanie 32, Zadanie 35.1, Zadanie 35.2
2015:
Zadanie 15, Zadanie 16, Zadanie 29, Zadanie 31, Zadanie 33.1, Zadanie 33.2, Zadanie 34
Wyjaśnienie różnic w temperaturach wrzenia kwasu karboksylowego i alkoholu względem aldehydu
W tabeli zebrano informacje na temat wybranych jednofunkcyjnych pochodnych alkanów o prostych łańcuchach węglowych. W kolumnie A podano ich masy molowe, a w kolumnie B odpowiadające im temperatury wrzenia (⁰C) pod ciśnieniem 1013 hPa.
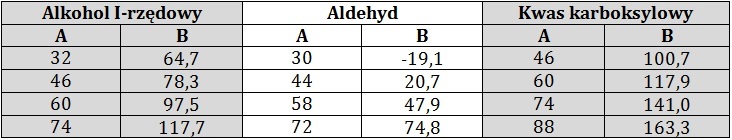
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Podaj przyczynę tak dużych różnic w wartościach temperatur wrzenia alkoholu oraz kwasu karboksylowego, w porównaniu z aldehydem o zbliżonej do nich masie molowej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyjaśnienie różnic w temperaturach wrzenia kwasu karboksylowego oraz alkoholu
W tabeli zebrano informacje na temat wybranych jednofunkcyjnych pochodnych alkanów o prostych łańcuchach węglowych. W kolumnie A podano ich masy molowe, a w kolumnie B odpowiadające im temperatury wrzenia (⁰C) pod ciśnieniem 1013 hPa.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Wyjaśnij, dlaczego temperatura wrzenia kwasu karboksylowego jest wyższa od temperatury wrzenia alkoholu o identycznej masie molowej? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie kolejności zmiany stanu skupienia przez związki organiczne
W tabeli zebrano informacje na temat wybranych jednofunkcyjnych pochodnych alkanów o prostych łańcuchach węglowych. W kolumnie A podano ich masy molowe, a w kolumnie B odpowiadające im temperatury wrzenia (⁰C) pod ciśnieniem 1013 hPa.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W czterech parownicach umieszczono próbki (po 5 ml każda) metanolu, kwasu mrówkowego, propanalu oraz etanolu i ostrożnie ogrzewano na łaźni olejowej.
W jakiej kolejności swój stan skupienia zmienią poszczególne związki chemiczne? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie wzoru sumarycznego pochodnej kwasu karboksylowego na podstawie procentu wagowego węgla
Wiadomo, że w dwudodatnich jonach metalicznego pierwiastka Y elektrony opisane są czternastoma orbitalami, przy czym elektrony sparowane – trzynastoma orbitalami. Wodny roztwór pewnego związku chemicznego zawiera wyżej opisane jony pierwiastka Y oraz aniony reszty kwasowej nasyconego kwasu monokarboksylowego. W cząsteczkach tego kwasu atomy węgla stanowią 40% masy.
Wykonaj niezbędne obliczenia, a następnie ustal wzór sumaryczny oraz nazwę systematyczną związku chemicznego, o którego wodnym roztworze mowa. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie wzorów grupowych cząsteczek dwóch izomerycznych kwasów karboksylowych
W cząsteczkach pewnych kwasów karboksylowych stosunek wagowy pierwiastków (C:H:O) wynosi 9:1:12, przy czym liczba atomów węgla równa jest liczbie atomów tlenu.
Narysuj wzory półstrukturalne cząsteczek opisanych związków chemicznych, wiedząc, że ich wzór rzeczywisty jest taki sam, jak wzór empiryczny, a atomy węgla połączone są wyłącznie wiązaniami typu sigma (σ). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie odczynu roztworu uzyskanego w punkcie równoważnikowym miareczkowania roztworu jednokarboksylowego kwasu
W kolbie stożkowej zawierającej 100 cm3 wody destylowanej z dodatkiem kilku kropli fenoloftaleiny umieszczono 2,96 g próbki pewnego nasyconego alifatycznego kwasu jednokarboksylowego. Zawartość naczynia wymieszano i uzupełniono wodą destylowaną do objętości 150 cm3, a następnie zmiareczkowano wodnym roztworem wodorotlenku sodu o stężeniu 0,4 mol∙dm-3. Punkt równoważnikowy osiągnięto w momencie wykorzystania 100 cm3 roztworu wodorotlenku.
Określ, jaki odczyn miał uzyskany w punkcie równoważnikowym miareczkowania roztwór? Odpowiedź uzasadnij równaniem reakcji chemicznej zapisanym w formie jonowej skróconej. Skorzystaj ze wzoru ogólnego szeregu homologicznego kwasów, do którego należy związek chemiczny opisany w informacji wprowadzającej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru sumarycznego kwasu jednokarboksylowego wykorzystując miareczkowanie
W kolbie stożkowej zawierającej 100 cm3 wody destylowanej z dodatkiem kilku kropli fenoloftaleiny umieszczono 2,96 g próbki pewnego nasyconego alifatycznego kwasu jednokarboksylowego. Zawartość naczynia wymieszano i uzupełniono wodą destylowaną do objętości 150 cm3, a następnie zmiareczkowano wodnym roztworem wodorotlenku sodu o stężeniu 0,4 mol∙dm-3. Punkt równoważnikowy osiągnięto w momencie wykorzystania 100 cm3 roztworu wodorotlenku.
Wykonaj niezbędne obliczenia i ustal wzór sumaryczny kwasu, którego wodny roztwór poddano miareczkowaniu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji towarzyszących przeprowadzonemu doświadczeniu z udziałem acetonu, etanalu i kwasu octowego
W trzech probówkach strącono wodorotlenek miedzi(II), a następnie w każdej z nich, w sposób losowy umieszczono wodne roztwory acetonu, etanalu oraz kwasu octowego. Każdym z naczyń energicznie wstrząśnięto i ogrzewano na łaźni wodnej o temperaturze około 90 ⁰C. Tylko w drugiej probówce zaobserwowano zmiany przed rozpoczęciem ogrzewania. W pierwszym i trzecim naczyniu po zakończeniu doświadczenia odnotowano zmianę barwy znajdującego się w nich osadu – odpowiednio na kolor czarny oraz ceglasty.
Określ, co zaobserwowano w drugiej probówce przed rozpoczęciem ogrzewania jej zawartości? Odpowiedź uzasadnij równaniem reakcji chemicznej, której przebiegowi towarzyszyły takie, a nie inne podane przez Ciebie obserwacje. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej na podstawie przeprowadzonego eksperymentu z utworzeniem czarnej substancji
W trzech probówkach strącono wodorotlenek miedzi(II), a następnie w każdej z nich, w sposób losowy umieszczono wodne roztwory acetonu, etanalu oraz kwasu octowego. Każdym z naczyń energicznie wstrząśnięto i ogrzewano na łaźni wodnej o temperaturze około 90 ⁰C. Tylko w drugiej probówce zaobserwowano zmiany przed rozpoczęciem ogrzewania. W pierwszym i trzecim naczyniu po zakończeniu doświadczenia odnotowano zmianę barwy znajdującego się w nich osadu – odpowiednio na kolor czarny oraz ceglasty.
Napisz równanie reakcji chemicznej, jaka doprowadziła do powstania czarnej substancji i podaj wzór sumaryczny związku chemicznego wchodzącego w skład ceglastego osadu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Bilansowanie równania reakcji kwasu szczawiowego z zakwaszonym roztworem manganianu(VII) potasu
Plamy pozostałe po manganianie(VII) potasu można wywabić roztworem kwasu szczawiowego z dodatkiem rozcieńczonego kwasu siarkowego(VI).
Napisz w formie jonowej skróconej równanie przebiegającej reakcji chemicznej, jaka prowadzi do usunięcia plam. Współczynniki uzgodnij metodą bilansu jonowo-elektronowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzorów półstrukturalnych izomerów geometrycznych kwasu karboksylowego (izomeria geometryczna)
W celu całkowitego przereagowania 1 g pewnego jednonienasyconego, monokarboksylowego kwasu alifatycznego zużyto 4 g 10% roztworu wodorotlenku sodu.
Podaj nazwę systematyczną tego kwasu oraz wzory półstrukturalne jego izomerów geometrycznych, jeśli wiadomo, że wszystkie atomy węgla w cząsteczkach tego związku chemicznego leżą na tej samej płaszczyźnie. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone