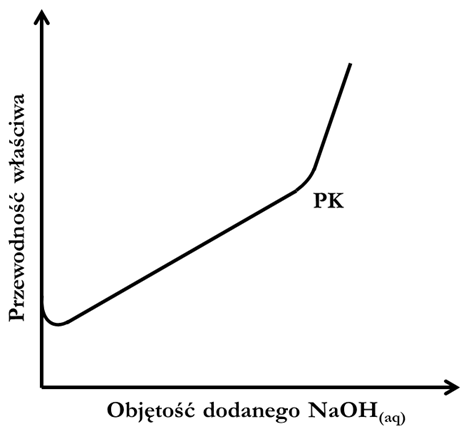
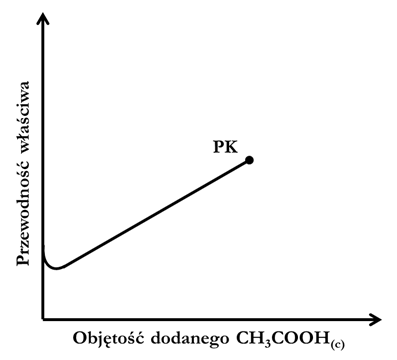
Przypisywanie określonych kwasów (acetylosalicylowego, octowego, mrówkowego) do probówek
W trzech nieoznakowanych probówkach losowo umieszczono wodne roztwory kwasów: acetylosalicylowego, octowego oraz mrówkowego. Przeprowadzono dwie serie doświadczeń z udziałem podanych substancji chemicznych.
1. W wyniku działania zakwaszonym roztworem dwuchromianu(VI) potasu zmianę barwy roztworu zaobserwowano w drugiej probówce.
2. Zawartość każdej z probówek odparowano do sucha. Tylko w pierwszym z naczyń zaobserwowano pojawienie się białego osadu.
Przyporządkuj probówkom 1÷3 nazwy organicznych związków chemicznych, których wodne roztwory poddano opisanym doświadczeniom. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej oraz obserwacji towarzyszących jej przebiegowi z udziałem kwasu karboksylowego
W trzech nieoznakowanych probówkach losowo umieszczono wodne roztwory kwasów: acetylosalicylowego, octowego oraz mrówkowego. Przeprowadzono dwie serie doświadczeń z udziałem podanych substancji chemicznych.
1. W wyniku działania zakwaszonym roztworem dwuchromianu(VI) potasu zmianę barwy roztworu zaobserwowano w drugiej probówce.
2. Zawartość każdej z probówek odparowano do sucha. Tylko w pierwszym z naczyń zaobserwowano pojawienie się białego osadu.
Napisz w formie jonowej skróconej równanie reakcji chemicznej, jaka przebiegła w drugiej probówce oraz drugi towarzyszący jej objaw i barwę roztworu po reakcji. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej z udziałem kwasu karboksylowego oraz roztworu wodorotlenku potasu
W trzech nieoznakowanych probówkach losowo umieszczono wodne roztwory kwasów: acetylosalicylowego, octowego oraz mrówkowego. Przeprowadzono dwie serie doświadczeń z udziałem podanych substancji chemicznych.
1. W wyniku działania zakwaszonym roztworem dwuchromianu(VI) potasu zmianę barwy roztworu zaobserwowano w drugiej probówce.
2. Zawartość każdej z probówek odparowano do sucha. Tylko w pierwszym z naczyń zaobserwowano pojawienie się białego osadu.
Do probówki, w której uzyskano biały osad dodano nadmiar roztworu wodorotlenku potasu.
Napisz równanie przebiegającej reakcji chemicznej. W tym celu wykorzystaj półstrukturalne wzory związków organicznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej z udziałem spirytusu salicylowego oraz roztworu wodorotlenku sodu
Przykładem środka odkażającego o słabym działaniu przeciwzapalnym jest Spirytus salicylowy, którego składnikami są kwas 2-hydroksybenzoesowy, etanol oraz woda.
W dwóch kolbach umieszczono po 50 cm3 Spirytusu salicylowego, a następnie do kolby nr 1 dodano kilka kryształków chlorku żelaza(III). Zawartością naczynia kilkukrotnie wstrząśnięto. Do kolby nr 2 dodano nadmiar roztworu wodorotlenku sodu. Zawartością naczynia kilkukrotnie wstrząśnięto i postąpiono analogicznie jak z zawartością kolby nr 1.
Korzystając z grupowych wzorów związków organicznych napisz równanie reakcji chemicznej, jaka przebiegła po dodaniu nadmiaru wodnego roztworu wodorotlenku sodu do Spirytusu salicylowego znajdującego się w kolbie nr 2. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie barwy roztworu po reakcji z udziałem chlorku żelaza(III) oraz uzasadnienie
Przykładem środka odkażającego o słabym działaniu przeciwzapalnym jest Spirytus salicylowy, którego składnikami są kwas 2-hydroksybenzoesowy, etanol oraz woda.
W dwóch kolbach umieszczono po 50 cm3 Spirytusu salicylowego, a następnie do kolby nr 1 dodano kilka kryształków chlorku żelaza(III). Zawartością naczynia kilkukrotnie wstrząśnięto. Do kolby nr 2 dodano nadmiar roztworu wodorotlenku sodu. Zawartością naczynia kilkukrotnie wstrząśnięto i postąpiono analogicznie jak z zawartością kolby nr 1.
Napisz, jaką barwę przyjął roztwór docelowy uzyskany w kolbie nr 1 oraz wyjaśnij, dlaczego w kolbie nr 2 nie uzyskano takiego samego rezultatu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór grupy funkcyjnej z kwasu salicylowego wraz z uzasadnieniem, która jako pierwsza przereaguje z jonem wodorotlenkowym
Kwas salicylowy jest kwasem dwuprotonowym, a jego stałe dysocjacji w temperaturze 298 K mają wartości 1,07∙10–3 oraz 1,58∙10–14.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Oceń, która z obecnych w cząsteczce tego kwasu grup funkcyjnych jako pierwsza przereaguje z jonem wodorotlenkowym? Uzasadnij odpowiedź. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzorów grupowych oraz nazw reagentów zamieszczonych na schemacie reakcyjnym
Produktem końcowym cyklu reakcji chemicznych jest pewien związek organiczny Z. Wiadomo, że w celu otrzymania związku X zastosowano nadmiar roztworu NaOH.
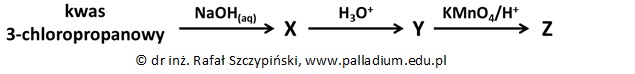
Narysuj wzory grupowe oraz napisz nazwy związków chemicznych oznaczonych literami X, Y, Z. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór związku chemicznego o wyższej temperaturze topnienia wraz z uzasadnieniem wyboru
Produktem końcowym cyklu reakcji chemicznych jest pewien związek organiczny Z. Wiadomo, że w celu otrzymania związku X zastosowano nadmiar roztworu NaOH.
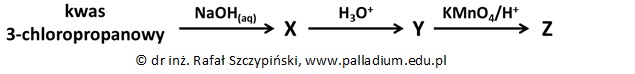
Określ, który ze związków chemicznych (X, czy Y) ma wyższą temperaturę topnienia? Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania połówkowego reakcji rozszczepienia cząsteczki alkenu zakwaszonym roztworem manganianu(VII) potasu
Kwasy karboksylowe mogą powstawać w wyniku rozszczepiania cząsteczek niektórych alkenów za pomocą zakwaszonego roztworu manganianu(VII) potasu. Na przykład, jeśli reakcji poddany zostanie alken o wzorze R1–CH=CH–R2, powstanie mieszanina kwasów karboksylowych. Do gorącego, zakwaszonego roztworu manganianu(VII) potasu wprowadzono pewien alken będący izomerem trans. W wyniku przebiegającej reakcji chemicznej roztwór odbarwił się, a w trakcie jej prowadzenia wyczuwalny był charakterystyczny zapach octu. Drugim produktem organicznym był najprostszy kwas karboksylowy, zawierający III-rzędowy atom węgla w cząsteczce.
Napisz, stosując bilans jonowo-elektronowy oraz grupowe wzory związków organicznych równanie połówkowe opisanego procesu rozszczepienia cząsteczki alkenu. Rysując wzór substratu uwzględnij izomerię geometryczną. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone