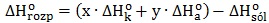Ocena, czy mamy do czynienia z reakcją równowagową wraz z uzasadnieniem
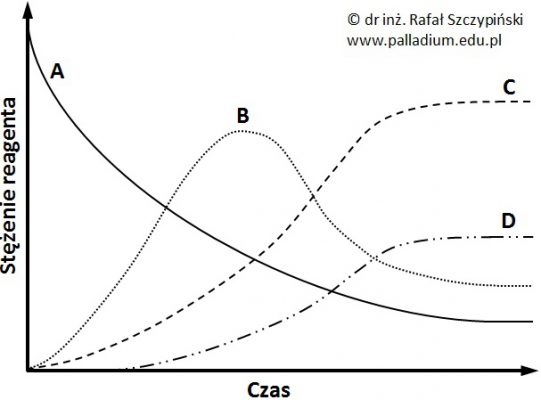
Produkty docelowe wielu procesów w technologii chemicznej powstają na skutek przebiegu kilku reakcji następczych. Rysunek poniżej przedstawia zmiany stężeń reagentów (A÷D) układu reakcyjnego w czasie prowadzenia pewnego procesu technologicznego, któremu towarzyszą dwie reakcje chemiczne.
Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
Na podstawie zamieszczonego wykresu określ, czy w układzie tym ustalił się stan równowagi dynamicznej? Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór odpowiedniego procesu technologicznego na podstawie wykresu zmian stężeń reagentów w czasie wraz z uzasadnieniem
Produkty docelowe wielu procesów w technologii chemicznej powstają na skutek przebiegu kilku reakcji następczych. Rysunek poniżej przedstawia zmiany stężeń reagentów (A÷D) układu reakcyjnego w czasie prowadzenia pewnego procesu technologicznego, któremu towarzyszą dwie reakcje chemiczne.

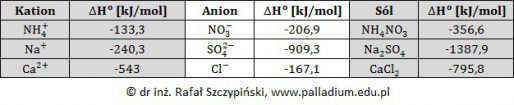
W tabeli poniżej zebrano dane na temat trzech niezależnych od siebie procesów chemicznych, podczas których biegną po dwie reakcje chemiczne.

Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
Spośród procesów (1÷3) podanych w tabeli wybierz jeden, którego reagentom można przypisać wykres zmian ich stężeń przedstawiony w informacji wprowadzającej. Uzasadnij swój wybór. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie entalpii tworzenia tlenku siarki(VI) na podstawie prawa Hessa
W tabeli poniżej zebrano dane na temat trzech niezależnych od siebie procesów chemicznych, podczas których biegną po dwie reakcje chemiczne.

Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
Na podstawie danych zebranych w odpowiednim wierszu tabeli oblicz efekt cieplny (entalpię) towarzyszący utworzeniu jednego mola tlenku siarki(VI) z pierwiastków w postaci termodynamicznie trwałej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie entalpii procesu całkowitego uwodornienia buta-1,3-dienu
W tabeli poniżej zebrano dane na temat trzech niezależnych od siebie procesów chemicznych, podczas których biegną po dwie reakcje chemiczne.

Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
Na podstawie danych zawartych w tabeli dotyczących procesu nr 2 określ wartość entalpii reakcji całkowitego uwodornienia jednego mola buta-1,3-dienu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie entalpii wieloetapowego procesu podczas otrzymywania tlenku siarki(VI)
W tabeli poniżej zebrano dane na temat trzech niezależnych od siebie procesów chemicznych, podczas których biegną po dwie reakcje chemiczne.

Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
W celu otrzymania tlenku siarki(VI) w procesie nr 1, spaleniu poddano 6,4 g siarki.
Zakładając 100% wydajność tej reakcji oraz 80% wydajność reakcji utleniania tlenku siarki(IV) określ, jaki będzie sumaryczny efekt cieplny (entalpia) procesu? Wynik obliczeń podaj z dokładnością do cyfry jedności. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie efektu cieplnego reakcji chemicznej z uzasadnieniem
W jednym z etapów produkcji kwasu azotowego(V) ustala się równowaga opisana równaniem:
2NO2(g) ⇄ N2O4(g)
W miarę obniżania temperatury ilość powstającego N2O4 stopniowo wzrasta i dochodzi do 80% objętościowych w temperaturze 300 K.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Określ, czy opisana reakcja chemiczna jest procesem egzo- czy endotermicznym? Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie ilości roztworu metanolu uzyskanego w wyniku przebiegu reakcji chemicznej (wydajność reakcji)
Na skalę techniczną metanol otrzymuje się w procesie, podczas przebiegu którego w układzie ustala się równowaga dynamiczna opisana równaniem:
CO(g) + 2H2(g) ⇄ CH3OH(g) ΔH = -128,2 kJ/mol
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Zakład przemysłowy dysponuje mieszaniną tlenku węgla(II) z wodorem, której masa wynosi 2,9 tony. W mieszaninie tej na każdą cząsteczkę wodoru przypadają dwie cząsteczki tlenku węgla(II).
Oblicz, jaką ilość 80%, wodnego roztworu metanolu można wyprodukować, jeśli przyjmiemy, że synteza tego alkoholu przebiega z wydajnością reakcji równą 80%? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie efektu cieplnego reakcji chemicznej oraz przyczyny konieczności ogrzania układu
W temperaturze bliskiej 333 K tlenek chloru(IV) ulega gwałtownej reakcji rozkładu:
2ClO2 → Cl2 + 2O2 ΔHo = -387 kJ
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Określ, czy rozkład ClO2 jest procesem egzo- czy endotermicznym oraz uzasadnij konieczność ogrzania układu reakcyjnego, w celu zainicjowania biegu opisanej reakcji. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości entalpii tworzenia tlenku chloru(IV)
W temperaturze bliskiej 333 K tlenek chloru(IV) ulega gwałtownej reakcji rozkładu:
2ClO2 → Cl2 + 2O2 ΔHo = -387 kJ
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Na podstawie efektu cieplnego podanej reakcji chemicznej określ wartość entalpii tworzenia tlenku chloru(IV). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena, czy reakcja kwasu solnego z roztworem zasady potasowej jest procesem endotermicznym czy egzotermicznym
Wraz ze wzrostem temperatury wzrasta wartość iloczynu jonowego wody (Kw), wielkości opisującej równowagę reakcji autodysocjacji wody:
2H2O ⇄ H3O+ + OH–
Napisz, czy w wyniku reakcji przebiegającej podczas wprowadzania wodnego roztworu kwasu solnego do wodnego roztworu wodorotlenku potasu następuje emisja energii cieplnej z układu do otoczenia. Uzasadnij odpowiedź. Odpowiedź: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczenia dotyczące wykorzystania wydzielonej na sposób ciepła energii do przeprowadzenia innej reakcji chemicznej
W tabeli poniżej zebrano dane na temat trzech niezależnych od siebie procesów chemicznych, podczas których biegną po dwie reakcje chemiczne.

Na podstawie: I. P. Muchlenow i inni, Ogólna technologia chemiczna, Warszawa 1974.
Efekt cieplny endotermicznej reakcji rozkładu jednego mola węglanu wapnia wynosi 178 kJ.
Przy założeniu 60% wydajności reakcji pierwszej oraz 90% wydajności drugiej reakcji w procesie nr 3, oblicz masę węglanu wapnia, jaka mogłaby zostać rozłożona wykorzystując wydzielone w procesie nr 3 ciepło, jeśli dysponujemy 34 g amoniaku. Przyjmij, że nie ma strat energii wynikających z jej wymiany z otoczeniem. Wynik obliczeń podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone