Obliczanie wartości stałej równowagi reakcji chemicznej syntezy amoniaku oraz odczyt wartości odpowiadającej jej temperatury
Poniższy wykres ilustruje charakterystykę zmian wartości stałej równowagi reakcji syntezy amoniaku w zakresie temperatur 298 K ÷ 2000 K.
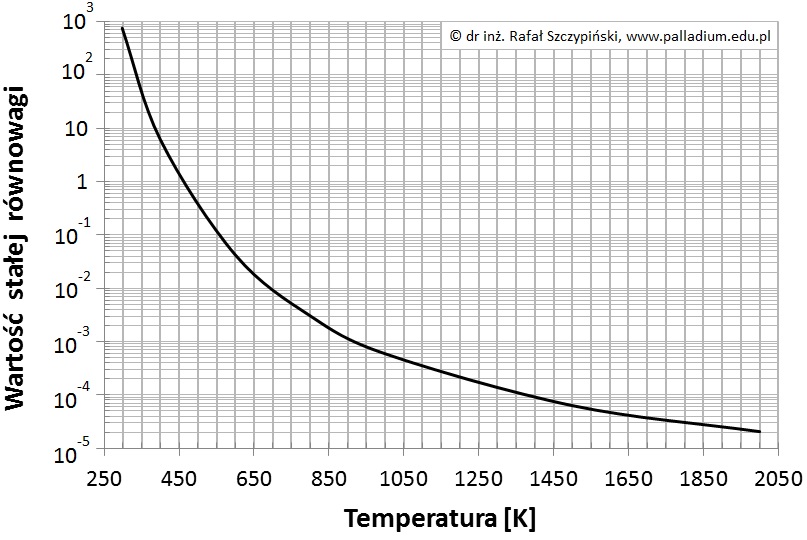
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W reaktorze o pojemności 2,24 dm3 przygotowano mieszaninę azotu z wodorem (warunki normalne), której masa wynosiła 0,72 g. Następnie przepompowano ją do reaktora o pojemności równej 1 dm3 i w obecności katalizatora, w pewnej temperaturze przeprowadzono syntezę amoniaku. Po ustaleniu się stanu równowagi dynamicznej, w układzie stwierdzono obecność 0,4 milimola produktu.
Oblicz wartość stałej równowagi reakcji syntezy amoniaku w opisanych w informacji wprowadzającej warunkach, a następnie na podstawie zamieszczonego wykresu oszacuj temperaturę, w jakiej przeprowadzono ten proces. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie dodatkowej ilości substratu, jaką należy wprowadzić do mieszaniny równowagowej w reakcji estryfikacji
Reakcję estryfikacji kwasu etanowego propan-2-olem opisuje równanie chemiczne:
CH3COOH + CH3CH(OH)CH3 ⇄ CH3COOCH(CH3)2 + H2O
W pewnej temperaturze stała równowagi tej reakcji ma wartość 1. W celu przeprowadzenia syntezy estru przygotowano mieszaninę kwasu etanowego i propan-2-olu, w której stosunek molowy substratów wynosił 5:2. Po ustaleniu się stanu równowagi, w układzie reakcyjnym stwierdzono obecność 2 moli etanianu prop-2-ylu.
Oblicz, jaką liczbę moli propan-2-olu należałoby dodatkowo wprowadzić do uzyskanej mieszaniny równowagowej, aby po ustaleniu się nowego stanu równowagi, w mieszaninie poreakcyjnej znajdowało się 5 moli estru? Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wprowadzonej liczby moli amoniaku, w celu powstania mieszaniny równowagowej o określonym składzie
Cyjanowodór jest cieczą wrzącą w temperaturze 299 K, a jego dawka śmiertelna wynosi 50 mg. Reakcję otrzymywania tego związku chemicznego opisuje równanie:
CH4(g) + NH3(g) ⇄ HCN(g) + 3H2(g) ΔHo = 252 kJ
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
W reaktorze o pojemności równej 1 dm3 umieszczono 4 mole metanu (CH4). Po wprowadzeniu do tego naczynia pewnej liczby moli amoniaku i ogrzaniu jego zawartości do temperatury T zainicjowano reakcję chemiczną, której stała równowagi w opisanych warunkach ma wartość 1.
Oblicz, jaką liczbę moli amoniaku wprowadzono do naczynia, jeśli w stanie równowagi liczba cząsteczek wodoru była taka sama, jak liczba cząsteczek metanu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stosunku molowego tlenku węgla(IV) i wodoru, w jakim powinny zostać zmieszane, w celu powstania mieszaniny równowagowej o określonym składzie
Podczas reakcji tlenku węgla(IV) z wodorem w naczyniu o pojemności 1 dm3, w pewnej temperaturze T ustala się równowaga, którą można przedstawić równaniem w postaci:
CO2(g) + H2(g) ⇄ CO(g) + H2O(g)
W opisanych warunkach stała równowagi tej reakcji chemicznej ma wartość 2.
Oblicz, w jakim stosunku molowym należy zmieszać tlenek węgla(IV) i wodór, aby po zainicjowaniu reakcji chemicznej i osiągnięciu stanu równowagi, w temperaturze T liczba moli wodoru była trzykrotnie mniejsza, niż liczba moli tlenku węgla(II)? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości stałej równowagi reakcji chemicznej z udziałem tlenku azotu(IV)
W jednym z etapów produkcji kwasu azotowego(V) ustala się równowaga opisana równaniem:
2NO2(g) ⇄ N2O4(g)
W miarę obniżania temperatury ilość powstającego N2O4 stopniowo wzrasta i dochodzi do 80% objętościowych w temperaturze 300 K.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Opisany proces prowadzono w reaktorze o pojemności równej 1 dm3.
Oblicz wartość stałej równowagi podanej reakcji chemicznej w temperaturze 300 K. Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości stałej równowagi reakcji odwrotnej do dimeryzacji tlenku azotu(IV)
W jednym z etapów produkcji kwasu azotowego(V) ustala się równowaga opisana równaniem:
2NO2(g) ⇄ N2O4(g)
W miarę obniżania temperatury ilość powstającego N2O4 stopniowo wzrasta i dochodzi do 80% objętościowych w temperaturze 300 K.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Oblicz wartość stałej równowagi reakcji chemicznej prowadzącej do przekształcenia dimeru N2O4 w tlenek NO2 w temperaturze 300 K, jeśli proces ten prowadzono w reaktorze o pojemności równej 1 dm3. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie ilości energii wydzielonej na sposób ciepła w procesie tworzenia się określonej masy pary wodnej
Standardowa entalpia tworzenia pary wodnej wynosi –242 kJ·mol–1.
Oblicz, ile energii na sposób ciepła wydzieli się, jeśli powstanie 7,2 g pary wodnej, w reakcji przedstawionej równaniem: 2H2(g) + O2(g) → 2H2O(g) © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

