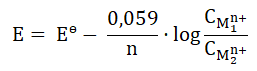Zapis równań reakcji elektrodowych przebiegających w pracującym ogniwie Volty
W ogniwie Volty blaszki – cynkowa oraz miedziana zanurzone są w rozcieńczonym roztworze kwasu siarkowego(VI). W celu zamknięcia obwodu elektrycznego, wystające ponad powierzchnię roztworu końce tych blaszek połączone są wówczas przewodnikiem.
Napisz równania reakcji elektrodowych jakie przebiegają w pracującym ogniwie Volty. Katoda: Anoda: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis sumarycznego równania reakcji przebiegającej w ogniwie chemicznym zbudowanym z półogniw redoks
Zbudowano ogniwo chemiczne z następujących półogniw redoks:
Fe3+ + ē ⇄ Fe2+ Eo = +0,771 V
MnO4– + 8H+ + 5ē ⇄ Mn2+ + 4H2O Eo = +1,503 V
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Napisz sumaryczne równanie reakcji chemicznej przebiegającej podczas pracy tego ogniwa oraz oblicz jego SEM w stanie standardowym. Równanie reakcji: SEM: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór jonu będącego najsilniejszym utleniaczem oraz zapis barwy roztworu
Zbudowano ogniwo chemiczne z następujących półogniw redoks:
Fe3+ + ē ⇄ Fe2+ Eo = +0,771 V
MnO4– + 8H+ + 5ē ⇄ Mn2+ + 4H2O Eo = +1,503 V
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Spośród jonów potencjałotwórczych znajdujących się w opisanym ogniwie chemicznym wybierz i napisz wzór sumaryczny tego, który jest najsilniejszym utleniaczem. Określ barwę roztworu związku chemicznego zawierającego wybrany przez Ciebie jon, jeśli w układzie nie będzie obecna żadna inna drobina nadająca zabarwienie. Wzór jonu: Barwa roztworu: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie potencjału redoks półogniwa dla różnych stężeń molowych jonów potencjałotwórczych
Wartość potencjału redoks półogniwa Pt|Fe2+, Fe3+ zależy od stężenia molowego każdego z jonów (Fe2+ oraz Fe3+) i w temperaturze 25 oC wyraża się zależnością zwaną równaniem Nernsta w postaci:
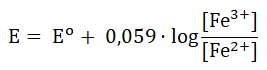
W wyrażeniu tym Eo to standardowy potencjał redoks półogniwa o wartości 0,771 V, natomiast [Fe3+] oraz [Fe2+] są stężeniami molowymi jonów potencjałotwórczych.
W temperaturze 25 oC zbudowano ogniwo chemiczne z dwóch półogniw Pt|Fe2+, Fe3+. W pierwszym z nich stężenie jonów Fe3+ było takie samo jak stężenie jonów Fe2+ w drugim półogniwie i wynosiło 0,5 mol·dm–3. Stężenia pozostałych jonów potencjałotwórczych w tych półogniwach odpowiadały stężeniu jonów chlorkowych w roztworze HCl o pH = 2.
Oblicz SEM opisanego ogniwa chemicznego w temperaturze 25 oC. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stałej równowagi reakcji przebiegającej w ogniwie cynkowo-kadmowym
W stanie równowagi (gdy ogniwo chemiczne uległo wyczerpaniu) standardową siłę elektromotoryczną ogniwa w temperaturze 298 K opisuje wyrażenie:
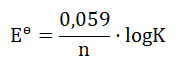
Wielkość K to stała równowagi reakcji redoks przebiegającej podczas pracy ogniwa, natomiast n to liczba moli elektronów wymienionych między utleniaczem i reduktorem.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
Oblicz stałą równowagi reakcji w temperaturze 298 K, przebiegającej w pracującym ogniwie zbudowanym z półogniw – cynkowego oraz kadmowego. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego określonego jonu po zakończeniu pracy ogniwa zbudowanego z półogniw pierwszego rodzaju
Zdolności utleniające drobin są tym silniejsze, im wyższa jest wartość potencjału redoks (E) półogniwa, którego są one składową. Na przykład wartość standardowego potencjału redoks półogniwa Cl2 + 2e ⇄ 2Cl– jest wyższa, niż półogniwa Br2 + 2e ⇄ 2Br–. W konsekwencji cząsteczki chloru mogą utlenić jony bromkowe do wolnego bromu, a reakcja taka może być zapisana równaniem: Cl2 + 2Br– → 2Cl– + Br2.
W ogniwie zbudowanym z półogniw metalicznych Zn/Zn2+ oraz Fe/Fe2+ oba roztwory miały taką samą objętość równą 500 cm3, a stężenia molowe jonów metali wynosiły po 0,01 mol·dm–3. Podczas pracy tego ogniwa masa płytki cynkowej zmieniła się o 130 mg.
Oblicz, jakie było stężenie (mmol·dm–3) jonów żelaza(II) po zakończeniu eksperymentu? Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
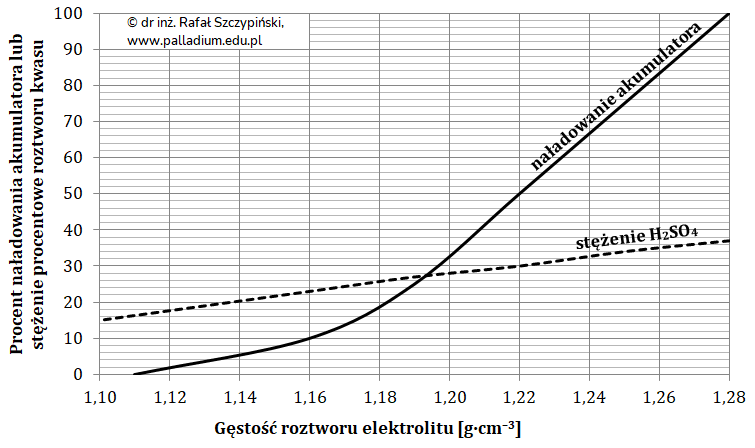
Obliczanie zmiany mas elektrod w akumulatorze kwasowo-ołowiowym po zakończeniu jego pracy (ogniwa)
Akumulator kwasowo-ołowiowy jest popularnym magazynem energii elektrycznej stosowanym w pojazdach spalinowych. Pojemność takiej baterii (zgromadzony w niej ładunek elektryczny) wyraża się w amperogodzinach (Ah). Na przykład, w temperaturze 25 oC akumulator o pojemności 50 Ah jest w stanie zasilać urządzenie elektryczne przez 50 godzin prądem o natężeniu 1 A. W tym czasie ulega on rozładowywaniu, co obrazują zachodzące na jego elektrodach reakcje chemiczne:
![]()
Na podstawie: www.intercars.pl
Pewien akumulator o pojemności 35 Ah został całkowicie rozładowany.
Oblicz, jak zmieniła się wówczas masa jego katody oraz anody. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis sumarycznego równania reakcji przebiegającej podczas ładowania akumulatora kwasowo-ołowiowego (ogniwa)
Akumulator kwasowo-ołowiowy jest popularnym magazynem energii elektrycznej stosowanym w pojazdach spalinowych. Pojemność takiej baterii (zgromadzony w niej ładunek elektryczny) wyraża się w amperogodzinach (Ah). Na przykład, w temperaturze 25 oC akumulator o pojemności 50 Ah jest w stanie zasilać urządzenie elektryczne przez 50 godzin prądem o natężeniu 1 A. W tym czasie ulega on rozładowywaniu, co obrazują zachodzące na jego elektrodach reakcje chemiczne:
![]()
Na podstawie: www.intercars.pl
Częściowo rozładowany akumulator można naładować. W trakcie tego procesu zmieniona zostaje polaryzacja elektrod, co w konsekwencji prowadzi do przebiegu reakcji odwrotnych.
Napisz w formie jonowej sumaryczne równanie procesu biegnącego podczas ładowania akumulatora kwasowo-ołowiowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone