Wskazanie nazwy oddziaływań narysowanych na schemacie fragmentu cząsteczki kewlaru. Zadanie 36. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Kewlar to handlowa nazwa poli(tereftalano-1,4-fenyloamidu). Tworzywo to jest około pięciu razy wytrzymalsze od stali, a zarazem około pięciu razy od niej lżejsze. Swoje właściwości kewlar zawdzięcza wysokiemu stopniowi uporządkowania cząsteczek. Ułożenie łańcuchów polimerowych kewlaru przedstawiono na poniższym schemacie.
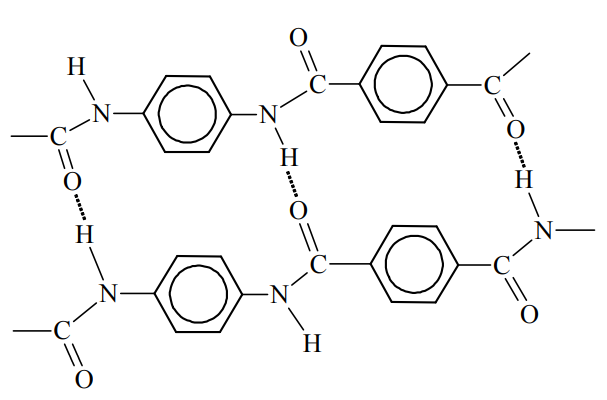
Podaj nazwę zaznaczonych na schemacie kropkami oddziaływań między atomami dwóch sąsiednich łańcuchów poli(tereftalano-1,4-fenyloamidu).
Uzupełnienie schematu reakcji syntezy kewlaru. Zadanie 37. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Kewlar to handlowa nazwa poli(tereftalano-1,4-fenyloamidu). Tworzywo to jest około pięciu razy wytrzymalsze od stali, a zarazem około pięciu razy od niej lżejsze. Swoje właściwości kewlar zawdzięcza wysokiemu stopniowi uporządkowania cząsteczek. Ułożenie łańcuchów polimerowych kewlaru przedstawiono na poniższym schemacie.

Kewlar otrzymuje się w reakcji polikondensacji dwóch rodzajów monomerów, z których jednym jest chlorek kwasu 1,4-benzenodikarboksylowego (tereftalowego).
Uzupełnij poniższy schemat syntezy kewlaru, wpisując wzór brakującego monomeru.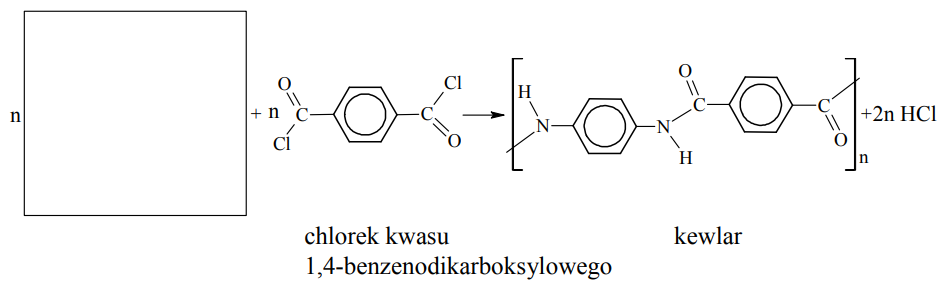
Przypisanie kewlaru do odpowiedniej grupy tworzyw sztucznych. Zadanie 38. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Kewlar to handlowa nazwa poli(tereftalano-1,4-fenyloamidu). Tworzywo to jest około pięciu razy wytrzymalsze od stali, a zarazem około pięciu razy od niej lżejsze. Swoje właściwości kewlar zawdzięcza wysokiemu stopniowi uporządkowania cząsteczek. Ułożenie łańcuchów polimerowych kewlaru przedstawiono na poniższym schemacie.

Zakwalifikuj kewlar do odpowiedniej grupy tworzyw. Podkreśl odpowiedź A, B, C lub D. A. poliamidy B. poliestry C. tworzywa fenolowe D. żywice epoksydowe
Określenie symbolu pierwiastka chemicznego oraz jego walencyjnej konfiguracji elektronowej. Zadanie 1. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Pewien pierwiastek X tworzy anion prosty o konfiguracji elektronowej atomu argonu. W stanie podstawowym w powłoce walencyjnej atomu pierwiastka X dwa orbitale p mają niesparowane elektrony.
Napisz symbol pierwiastka X oraz podaj konfigurację elektronową powłoki walencyjnej atomu tego pierwiastka. Symbol pierwiastka X: Konfiguracja elektronowa powłoki walencyjnej:
Wybór drobin spełniających określone kryteria dotyczące ich struktury. Zadanie 2abc. Arkusz CKE chemia maj 2011 rozszerzony (3 punkty)
Przeanalizuj budowę następujących cząsteczek i jonów: CH4, H3O+, NH3, CO2 i napisz wzór tej drobiny,
a) w której wiążąca para elektronowa pochodzi od jednego atomu. b) w której wszystkie elektrony walencyjne biorą udział w tworzeniu wiązań. c) która ma kształt liniowy.
Wybór cząsteczek pomiędzy którymi tworzą się wiązania wodorowe. Zadanie 3a. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Pomiędzy cząsteczkami, w których obecne są atomy wodoru związane bezpośrednio z silnie elektroujemnymi atomami niemetalu (fluoru, tlenu, azotu), tworzą się wiązania wodorowe mające wpływ na właściwości fizyczne związku.
Spośród związków o wzorach: CH3OH, CH3COCH3, CH3F, CH3NH2, CH3CH3, CH3Cl wybierz i napisz wzory tych, których cząsteczki tworzą wiązania wodorowe.
Uszeregowanie związków chemicznych zgodnie ze wzrostem ich lotności. Zadanie 3b. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Pomiędzy cząsteczkami, w których obecne są atomy wodoru związane bezpośrednio z silnie elektroujemnymi atomami niemetalu (fluoru, tlenu, azotu), tworzą się wiązania wodorowe mające wpływ na właściwości fizyczne związku.
Wiązania wodorowe utrudniają przejście związku w stan gazowy, ponieważ powodują asocjację cząsteczek – łączenie się ich w większe agregaty. Wiązania te są tym silniejsze, im bardziej elektroujemny jest atom niemetalu będący donorem pary elektronowej.
Uszereguj związki o wzorach: CH3CH3, CH3NH2, CH3OH zgodnie ze wzrastającą lotnością (od najmniejszej do największej).
Ocena poprawności zdań dotyczących energii jonizacji pierwiastków chemicznych. Zadanie 4. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Pierwsza energia jonizacji (Ej) to minimalna energia potrzebna do oderwania jednego elektronu od obojętnego atomu. Na poniższym wykresie przedstawiono zmiany pierwszej energii jonizacji pierwiastków uszeregowanych według liczb atomowych.
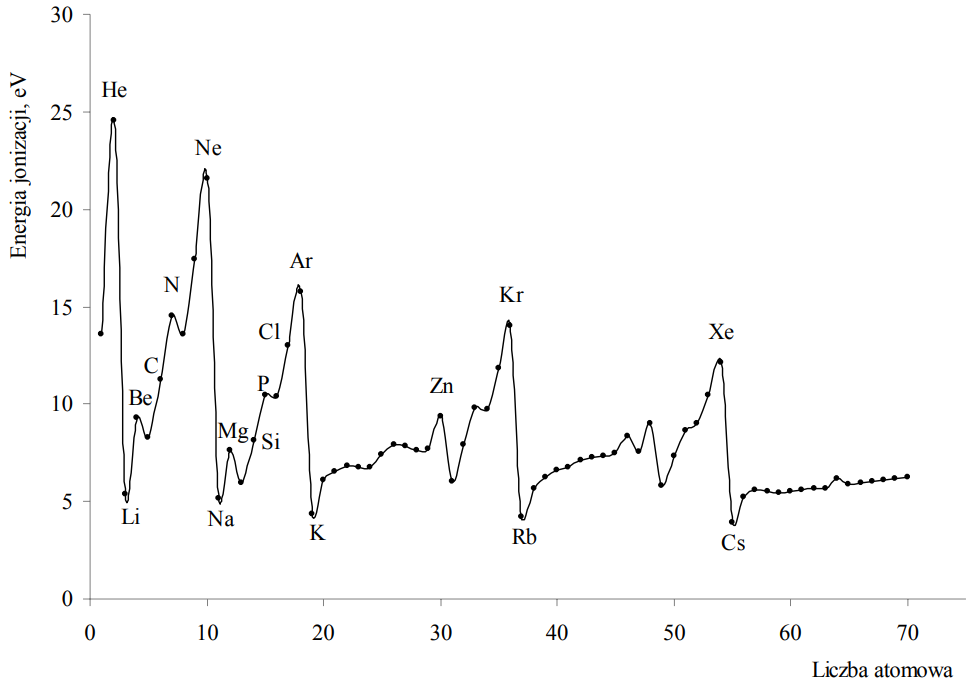
Oceń prawdziwość poniższych zdań i uzupełnij tabelę. Wpisz literę P, jeżeli uznasz zdanie za prawdziwe, lub literę F, jeżeli uznasz je za fałszywe. 1. W szeregu pierwiastków: lit, beryl, węgiel i azot wraz ze wzrostem liczby atomowej obserwujemy zależność polegającą na tym, że im więcej elektronów 2. W szeregu pierwiastków: hel, neon, argon, krypton i ksenon wraz ze wzrostem liczby atomowej obserwujemy zwiększanie się promienia atomowego i wzrost wartości pierwszej energii jonizacji. 3. Magnez ma mniejszy promień atomowy niż glin i większą wartość pierwszej energii jonizacji.
znajduje się na powłoce zewnętrznej, tym większa jest wartość pierwszej energii jonizacji.
Zapis równania reakcji jądrowej powstawania trytu. Zadanie 5. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Tryt 3H (T) jest nietrwałym izotopem wodoru o okresie półtrwania 12,3 lat, który emituje cząstki β–. Powstaje on między innymi w wyższych warstwach atmosfery na skutek zderzeń neutronów z atomami azotu 14N. W przemianie tej obok trytu powstaje także trwały izotop węgla. Tryt w reakcji z tlenem tworzy wodę trytową, która w opadach przedostaje się do wód powierzchniowych. Szacuje się, że w 1 cm3 wody będącej w naturalnym obiegu znajduje się 6·104 atomów trytu.
Napisz równanie reakcji wytwarzania trytu w wyższych warstwach atmosfery. Uzupełnij poniższy schemat.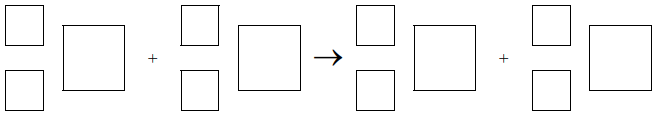
Określenie liczby atomów trytu w jednym litrze wody. Zadanie 6. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Tryt 3H (T) jest nietrwałym izotopem wodoru o okresie półtrwania 12,3 lat, który emituje cząstki β–. Powstaje on między innymi w wyższych warstwach atmosfery na skutek zderzeń neutronów z atomami azotu 14N. W przemianie tej obok trytu powstaje także trwały izotop węgla. Tryt w reakcji z tlenem tworzy wodę trytową, która w opadach przedostaje się do wód powierzchniowych. Szacuje się, że w 1 cm3 wody będącej w naturalnym obiegu znajduje się 6·104 atomów trytu.
Podaj w przybliżeniu, w ilu dm3 wody będącej w naturalnym obiegu znajduje się 1 mol atomów trytu.
Określenie liczby atomów trytu pozostałych w próbce po 40 latach. Zadanie 7. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Tryt 3H (T) jest nietrwałym izotopem wodoru o okresie półtrwania 12,3 lat, który emituje cząstki β–. Powstaje on między innymi w wyższych warstwach atmosfery na skutek zderzeń neutronów z atomami azotu 14N. W przemianie tej obok trytu powstaje także trwały izotop węgla. Tryt w reakcji z tlenem tworzy wodę trytową, która w opadach przedostaje się do wód powierzchniowych. Szacuje się, że w 1 cm3 wody będącej w naturalnym obiegu znajduje się 6·104 atomów trytu.
Próbkę wody o objętości 10 cm3 umieszczono w naczyniu i szczelnie zamknięto.
Na podstawie poniższego wykresu przedstawiającego zależność liczby atomów trytu w 1 cm3 wody od czasu oszacuj, ile atomów trytu pozostanie w próbce wody o objętości 10 cm3 po 40 latach. Po 40 latach w próbce pozostanie około atomów trytu.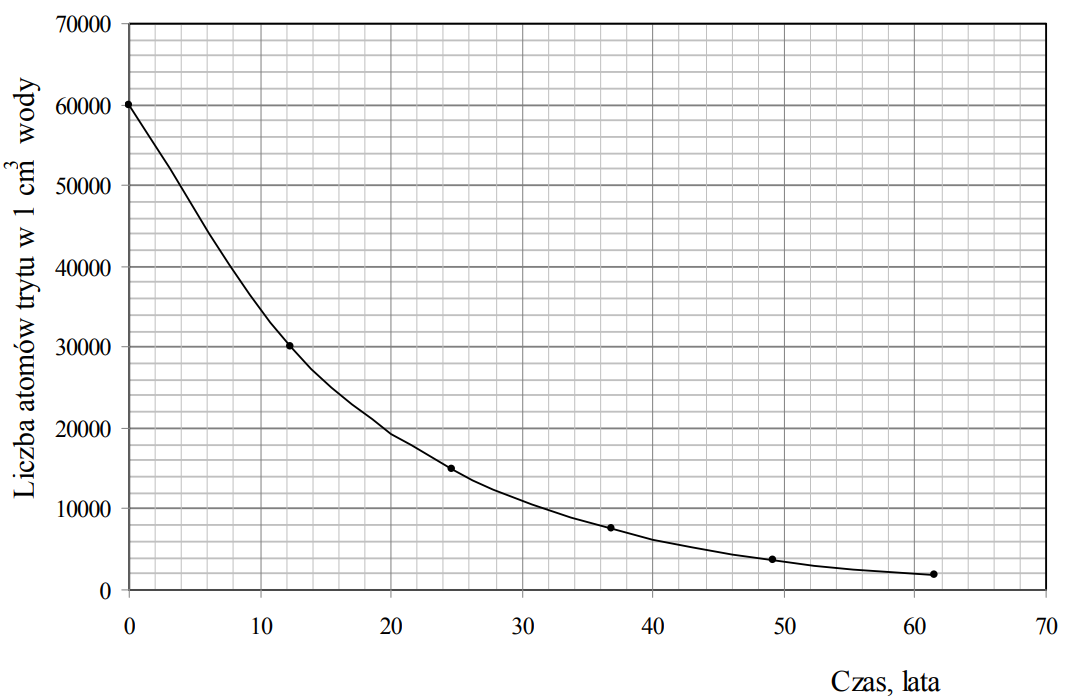
Obliczanie stężenia procentowego sacharozy po przerwaniu reakcji hydrolizy. Zadanie 8. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Sporządzono 200 g roztworu zawierającego 100 g sacharozy. Sacharozę poddano reakcji hydrolizy:
![]()
Reakcję przerwano w momencie, gdy całkowite stężenie cukrów redukujących w roztworze było równe 40% masowych.
Oblicz stężenie sacharozy, wyrażone w procentach masowych, w roztworze po przerwaniu reakcji. W obliczeniach przyjmij przybliżone wartości mas molowych:![]()
Zapis wzoru sprzężonego kwasu Brønsteda oraz wzoru sprzężonej zasady Brønsteda. Zadanie 9a. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Zgodnie z teorią Brønsteda kwas i sprzężona z nim zasada różnią się o jeden proton, przy czym im silniejszy jest kwas, tym słabsza jest sprzężona z nim zasada.
Uzupełnij poniższą tabelę, wpisując wzory brakującej sprzężonej zasady i brakującego sprzężonego kwasu.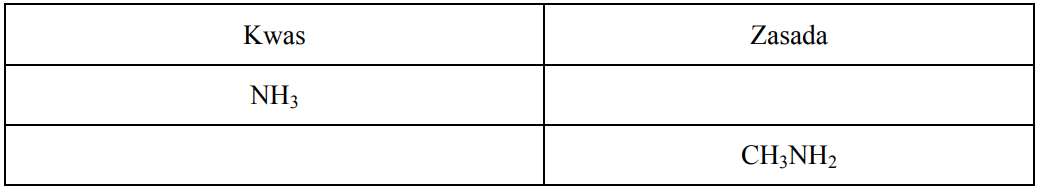
Wskazanie najsłabszej zasady Brønsteda. Zadanie 9b. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Zgodnie z teorią Brønsteda kwas i sprzężona z nim zasada różnią się o jeden proton, przy czym im silniejszy jest kwas, tym słabsza jest sprzężona z nim zasada.
Korzystając z zamieszczonej powyżej informacji, wskaż najsłabszą spośród następujących zasad: Cl–, HS–, CH3COO–, C6H5O–. Najsłabszą zasadą jest:

