Określenie symbolu pierwiastka chemicznego oraz wskazanie jego położenia w układzie okresowym. Zadanie 1. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Atomy pierwiastka X tworzą kationy X2+ o następującej konfiguracji elektronowej: 1s2 2s2 2p6 3s2 3p6 3d10.
Podaj symbol pierwiastka X, określ jego położenie w układzie okresowym i blok energetyczny (konfiguracyjny), do którego pierwiastek ten należy.
Wybór właściwych określeń dotyczących orbitalu atomowego. Zadanie 2. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Pewien orbital atomowy opisują liczby kwantowe o następujących wartościach:
główna liczba kwantowa n = 4
poboczna liczba kwantowa l = 2
magnetyczna liczba kwantowa ml = 0
Uzupełnij poniższe zdanie, wybierając symbol podpowłoki, do której należy ten orbital, oraz maksymalną liczbę elektronów na tej podpowłoce. Podkreśl wybrany symbol podpowłoki i liczbę elektronów. Opisany orbital należy do podpowłoki ( 4s / 4p / 4d / 4f ), na której maksymalna liczba elektronów wynosi ( 2 / 6 / 10 / 14 ).
Wskazanie liczb wiązań sigma oraz pi w schematach cząsteczek. Zadanie 3. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Poniżej przedstawiono wzory elektronowe dwóch cząsteczek.

Określ liczbę wiązań σ i π w cząsteczkach, których budowę elektronową ilustrują oba wzory.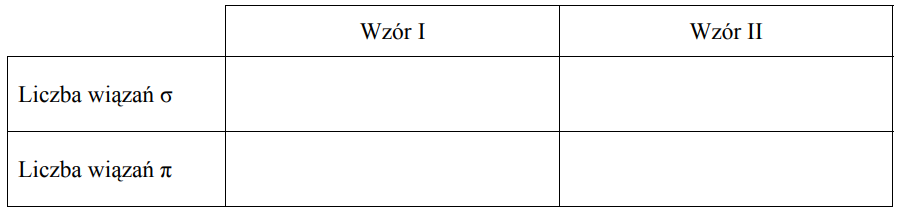
Zapis równania przemiany jądrowej. Zadanie 4. Arkusz CKE chemia maj 2013 rozszerzony (1 punkt)
Poniższy schemat przedstawia początkowy fragment szeregu promieniotwórczego toru. Numerami w kółkach oznaczono kolejne nuklidy, a strzałkami przemiany jądrowe, jakim te nuklidy ulegają.
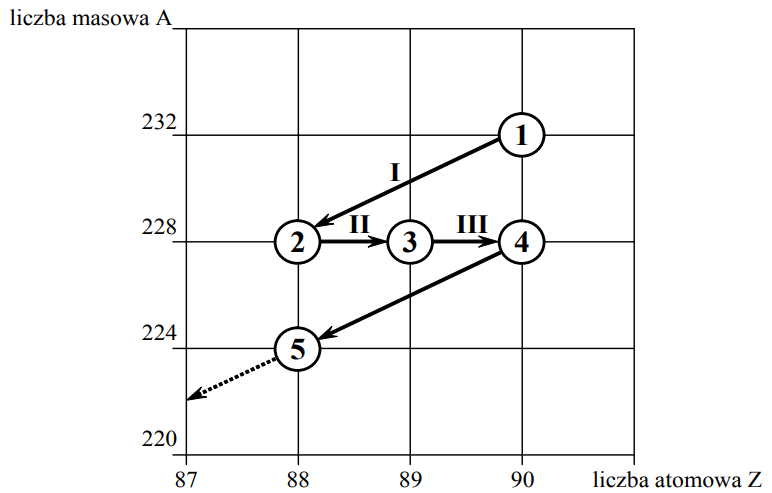
Napisz równanie przemiany jądrowej oznaczonej na schemacie numerem III. Podaj symbole oraz wartości liczby masowej i liczby atomowej jąder, będących substratami i produktami tej przemiany.
Przypisanie wzoru chemicznego cząsteczki do odpowiedniej geometrii. Zadanie 5. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Poniżej zamieszczono schematy ilustrujące budowę cząsteczek wybranych związków kowalencyjnych (schematy nie uwzględniają proporcji rozmiarów atomów).
Każdemu schematowi przyporządkuj wzór związku chemicznego, którego cząsteczkom można przypisać geometrię zilustrowaną tym schematem. Wzory wybierz spośród następujących: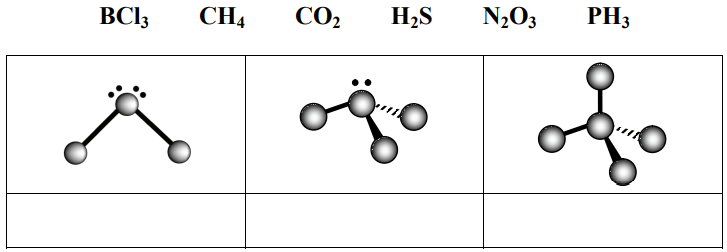
Wskazanie probówki, w której reakcja przebiegła szybciej. Zadanie 6. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
W dwóch probówkach oznaczonych numerami I i II umieszczono taką samą ilość wiórków magnezowych. Następnie do probówek wprowadzono jednakowe objętości kwasu solnego o temperaturze 25 ºC ale różnych stężeniach. Przebieg doświadczenia ilustruje poniższy
rysunek.
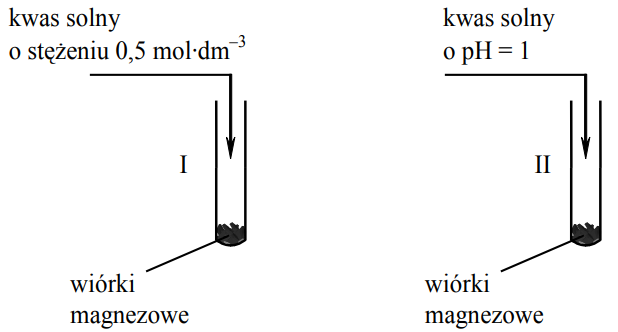
Napisz numer probówki, w której reakcja kwasu solnego z magnezem zaszła szybciej. Reakcja zaszła szybciej w probówce numer:
Obliczanie entalpii w reakcji rozkładu 50 gramów węglanu wapnia. Zadanie 7. Arkusz CKE chemia maj 2012 rozszerzony (2 punkty)
Poniżej podano wartości standardowej entalpii tworzenia trzech związków chemicznych.
CO2 (g) ΔHo1 = – 394 kJ·mol–1
CaO (s) ΔHo2 = – 635 kJ·mol–1
CaCO3 (s) ΔHo3 = – 1207 kJ·mol–1
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007
Korzystając z powyższych danych, oblicz wartość entalpii ΔHox reakcji rozkładu 50 gramów węglanu wapnia, która zachodzi zgodnie z równaniem CaCO3 (s) → CaO (s) + CO2 (g)
Wskazanie wzoru soli na podstawie wartości entalpii rozpuszczania. Zadanie 8. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
W dwóch probówkach znajdowała się woda destylowana o temperaturze 25 ºC. Do probówki I wprowadzono pewną liczbę moli soli A, a do probówki II – taką samą liczbę moli soli B. Stwierdzono, że w probówce I powstały roztwór jest cieplejszy od użytej wody destylowanej, natomiast zawartość probówki II nieco ochłodziła się w czasie rozpuszczania w niej soli B.
Wiedząc, że do przygotowania roztworów użyto chlorku magnezu i azotanu(V) amonu, a standardowe entalpie rozpuszczania w wodzie tych soli wynoszą ΔHo (MgCl2) = – 154 kJ·mol–1 ΔHo (NH4NO3) = 26 kJ·mol–1 napisz wzór soli, której roztwór otrzymano w probówce I. Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007 W probówce I otrzymano roztwór:
Obliczanie objętości dwutlenku węgla powstałego w wyniku spalenia paliwa. Zadanie 9. Arkusz CKE chemia maj 2012 rozszerzony (2 punkty)
W pewnych warunkach temperatury i ciśnienia, innych niż warunki normalne, odmierzono 1,00 dm3 gazowego paliwa, którego 55% objętości stanowił propan, 44% objętości stanowił butan, a 1% objętości – składniki niepalne.
Oblicz objętość tlenku węgla(IV), który powstanie w tych samych warunkach temperatury i ciśnienia w wyniku całkowitego spalenia odmierzonej objętości paliwa zgodnie z równaniami C3H8 + 5O2 → 3CO2 + 4H2O i 2C4H10 + 13O2 → 8CO2 + 10H2O Wynik podaj z dokładnością do drugiego miejsca po przecinku.
Obliczanie stężenia molowego jonu na podstawie stężeń molowych pozostałych jonów. Zadanie 10. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
W poniższej tabeli podano wzory wszystkich kationów i anionów, których obecność stwierdzono w badanym roztworze wodnym, oraz wartości stężenia tych jonów – z wyjątkiem anionów siarczanowych(VI).
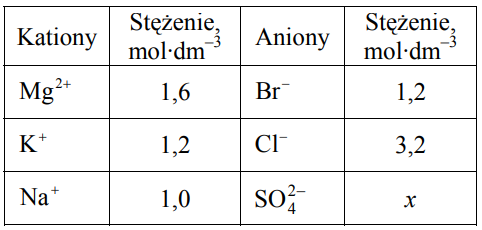
Wiedząc, że każdy roztwór jest elektrycznie obojętny, ustal wartość stężenia molowego x anionów siarczanowych(VI) w badanym roztworze. Wynik podaj z dokładnością do jednego miejsca po przecinku.
Zapis w formie jonowej skróconej odpowiedniego równania reakcji na podstawie opisu reagentów. Zadanie 11. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
W poniższej tabeli podano wzory wszystkich kationów i anionów, których obecność stwierdzono w badanym roztworze wodnym, oraz wartości stężenia tych jonów – z wyjątkiem anionów siarczanowych(VI).

Próbkę badanego roztworu (o składzie podanym w tabeli) poddano działaniu chloru. W wyniku reakcji roztwór zabarwił się na kolor żółtopomarańczowy. Substancją, która spowodowała to zabarwienie, była czerwonobrunatna lotna ciecz o charakterystycznym ostrym zapachu. Substancja ta reaguje z większością metali oraz niektórymi niemetalami, a także z nienasyconymi związkami organicznymi.
Napisz w formie jonowej skróconej równanie reakcji odpowiedniego składnika badanego roztworu z chlorem, w wyniku której powstała opisana substancja.
Uzupełnienie tabeli odpowiednimi wartościami liczbowymi oraz określenie odczynu roztworu. Zadanie 12ab. Arkusz CKE chemia maj 2012 rozszerzony (2 punkty)
a) Uzupełnij tabelę, wpisując wartość stężenia jonów OH– oraz wartość pH i pOH roztworu wodnego, w którym stężenie jonów H+ jest równe 10–9 mol·dm–3. b) Określ odczyn opisanego roztworu.
Obliczanie pH roztworu powstałego po zmieszaniu kwasu solnego z roztworem zasady sodowej. Zadanie 13. Arkusz CKE chemia maj 2012 rozszerzony (2 punkty)
Do 150,00 cm3 wodnego roztworu NaOH o stężeniu 0,54 mol·dm–3 dodano 50,00 cm3 kwasu solnego o stężeniu 2,02 mol·dm–3.
Oblicz pH otrzymanego roztworu.
Uszeregowanie sprzężonych zasad od najsłabsze do najmocniejszej. Zadanie 14. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Związek między mocą kwasu Brønsteda i sprzężonej z tym kwasem zasady w roztworach wodnych przedstawia zależność:
Ka · Kb = Kw
gdzie Ka oznacza stałą dysocjacji kwasu, Kb stałą dysocjacji sprzężonej zasady, a Kw iloczyn jonowy wody, którego wartość wynosi 1,0 · 10–14 w temperaturze 298 K. W poniższej tabeli podano wartości stałej dysocjacji wybranych kwasów w temperaturze 298 K.
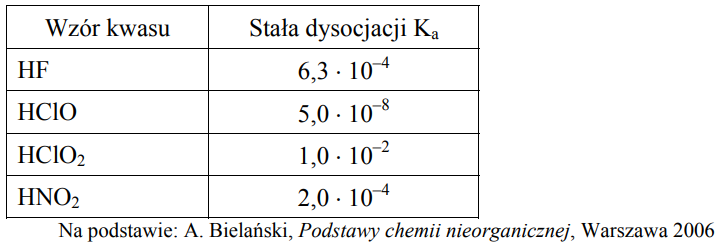
Na podstawie powyższej informacji napisz wzory zasad sprzężonych z kwasami wymienionymi w tabeli uporządkowane od najsłabszej do najmocniejszej. ![]()
Zapis równań reakcji chemicznych z udziałem związków kobaltu. Zadanie 15ab. Arkusz CKE chemia maj 2012 rozszerzony (3 punkty)
W reakcji wodnego roztworu chlorku kobaltu(II) z wodnym roztworem wodorotlenku sodu najpierw powstaje niebieski osad hydroksosoli: chlorku wodorotlenku kobaltu(II) o wzorze Co(OH)Cl. Związek ten pod wpływem kolejnych porcji roztworu wodorotlenku sodu przechodzi w różowy osad wodorotlenku kobaltu(II), który praktycznie nie rozpuszcza się w nadmiarze tego odczynnika, ale brunatnieje wskutek utleniania obecnym w powietrzu tlenem.
Opisane przemiany ilustruje poniższy schemat.
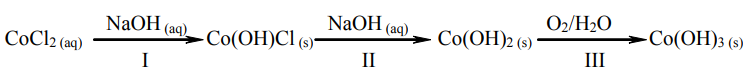
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, t. 2, Warszawa 2005, J. Minczewski, Z. Marczenko, Chemia analityczna. Podstawy teoretyczne i analiza jakościowa, Warszawa 2001
a) Napisz w formie jonowej skróconej równania reakcji oznaczonych numerami I i II. I: II: b) Napisz w formie cząsteczkowej równanie reakcji oznaczonej numerem III. III: