Wskazanie liczby wiązań sigma oraz pi w cząsteczce. Zadanie 22. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Podaj liczbę wszystkich wiązań σ i wiązańπ w cząsteczce związku organicznego o wzorze: CH≡CCHO Liczba wiązań σ: Liczba wiązań π:
Rysowanie wzoru grupowego alkenu oraz kwasów będących produktami jego utleniania. Zadanie 23ab. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Jedną z ogólnych metod określania struktury związku jest degradacja – rozpad cząsteczki związku o nieznanej strukturze na kilka mniejszych cząsteczek, łatwiejszych do zidentyfikowania. Metoda ta jest wykorzystywana do określania położenia podwójnego wiązania w cząsteczkach alkenów. Stosowane jest wówczas ich utlenianie, np. za pomocą roztworu KMnO4, prowadzone w środowisku kwasowym. Podczas tej reakcji, w zależności od budowy cząsteczki alkenu, mogą powstać kwasy karboksylowe, ketony lub tlenek węgla(IV).
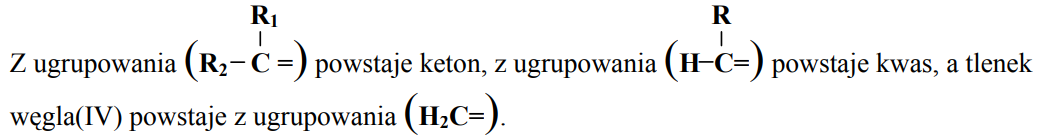
Pewien alken utleniany nadmiarem KMnO4 w środowisku kwasowym daje dwa różne kwasy karboksylowe, zaś w reakcji 1 mola tego alkenu z 1 molem wodoru powstaje n-heksan. a) Napisz wzór półstrukturalny (grupowy) tego alkenu. b) Podaj nazwy systematyczne dwóch kwasów karboksylowych powstałych podczas utleniania tego alkenu. 1. 2.
Zapis obserwacji pozwalających na odróżnienie związków chemicznych. Zadanie 24. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Jedną z ogólnych metod określania struktury związku jest degradacja – rozpad cząsteczki związku o nieznanej strukturze na kilka mniejszych cząsteczek, łatwiejszych do zidentyfikowania. Metoda ta jest wykorzystywana do określania położenia podwójnego wiązania w cząsteczkach alkenów. Stosowane jest wówczas ich utlenianie, np. za pomocą roztworu KMnO4, prowadzone w środowisku kwasowym. Podczas tej reakcji, w zależności od budowy cząsteczki alkenu, mogą powstać kwasy karboksylowe, ketony lub tlenek węgla(IV).
W dwóch nieoznakowanych kolbach znajdowały się dwa alkeny (każdy w innym naczyniu). Wiadomo, że jednym związkiem był 2-metyloprop-1-en, a drugim but-2-en. W celu odróżnienia 2-metyloprop-1-enu od but-2-enu przeprowadzono doświadczenie, podczas którego do obu naczyń dodano zakwaszony, wodny roztwór KMnO4.
Korzystając z powyższych informacji, wymień po jednej obserwacji, która pozwoli na odróżnienie obu związków. Uzupełnij poniższą tabelę.
Rysowanie wzorów merów powstałych w wyniku polimeryzacji buta-1,3-dienu. Zadanie 25. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Buta-1,3-dien to związek o wzorze CH2=CH–CH=CH2. Jest on produktem wyjściowym do otrzymywania kauczuku syntetycznego. Polimeryzacja buta-1,3-dienu może przebiegać w położeniach 1, 4 lub 1, 2. W pierwszym przypadku powstają makrocząsteczki o nienasyconych łańcuchach liniowych, w drugim przypadku łańcuch główny polimeru nie zawiera podwójnych wiązań, natomiast występują one w łańcuchach bocznych
Napisz wzory merów obu polimerów, powstających w reakcji polimeryzacji buta-1,3-dienu, wiedząc, że mer to najmniejszy, powtarzający się fragment budowy łańcucha polimeru.
Przypisywanie stopni utlenienia atomom węgla. Zadanie 26. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Określ stopnie utlenienia atomów węgla (podkreślone symbole) w cząsteczkach, których wzory podano w tabeli.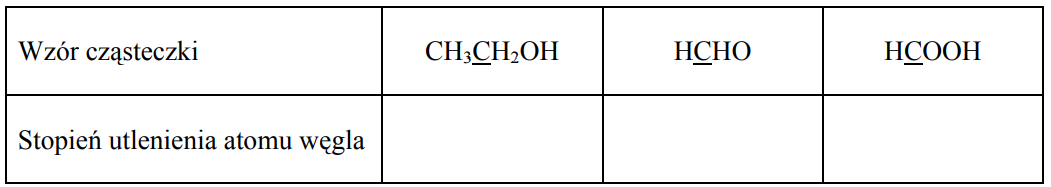
Wskazanie nazw grup związków chemicznych oraz zapis równania hydrolizy związku chemicznego. Zadanie 27ab. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Związek organiczny X o wzorze sumarycznym C7H6O2 ulega reakcji hydrolizy. Produktami tej reakcji w środowisku kwasowym są związki Y i Z. Substancja Y, jako jedyny przedstawiciel swojego szeregu homologicznego, ma właściwości redukujące. Związek Z w reakcji z chlorkiem żelaza(III) daje związek kompleksowy o fioletowej barwie.
a) Podaj nazwy grup związków, do których należą substancje organiczne X, Y i Z. X: Y: Z: b) Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie reakcji hydrolizy kwasowej związku organicznego X.
Rysowanie wzorów dwóch izomerycznych związków organicznych. Zadanie 28. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Dwa związki organiczne A i B są względem siebie izomerami. W wyniku bromowania zarówno związku A jak i związku B powstaje kwas 2,3-dibromobutanowy.
Narysuj wzory strukturalne związków A i B, tak aby jednoznacznie wskazywały na występujący w nich rodzaj izomerii.
Rysowanie wzoru chiralnego triglicerydu. Zadanie 29. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Cząsteczki glicerolu, kwasu palmitynowego C15H31COOH i kwasu stearynowego C17H35COOH są achiralne, ale cząsteczki związku powstającego w reakcji glicerolu z tymi kwasami mogą być chiralne.
Narysuj wzór triglicerydu, zawierającego reszty kwasów palmitynowego i stearynowego, którego cząsteczki są chiralne.
Rysowanie projekcji Fischera L-arabinozy. Zadanie 30. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
L-arabinoza jest aldopentozą, w cząsteczce której grupa -OH przy atomie węgla połączonym z grupą aldehydową znajduje się po przeciwnej stronie niż grupy -OH przy pozostałych asymetrycznych atomach węgla.
Na podstawie podanej informacji uzupełnij rysunek, tak aby był on wzorem L-arabinozy w projekcji Fischera.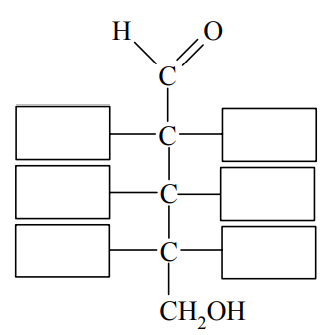
Projektowanie doświadczenia, które pozwoli na rozróżnienie wodnych roztworów glukozy i fruktozy. Zadanie 31ab. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Zaprojektuj doświadczenie, które pozwoli na rozróżnienie wodnych roztworów dwóch cukrów: glukozy i fruktozy.
a) Uzupełnij schemat doświadczenia, wpisując nazwę użytego odczynnika wybranego z podanej poniżej listy: – świeżo wytrącony wodorotlenek miedzi(II) b) Napisz, jakie obserwacje potwierdzą obecność glukozy w probówce I i fruktozy w probówce II po wprowadzeniu tych substancji do wybranego odczynnika (wypełnij poniższą tabelę).
- woda bromowa z dodatkiem wodnego roztworu wodorowęglanu sodu
- wodny roztwór azotanu(V) srebra z dodatkiem wodnego roztworu amoniaku.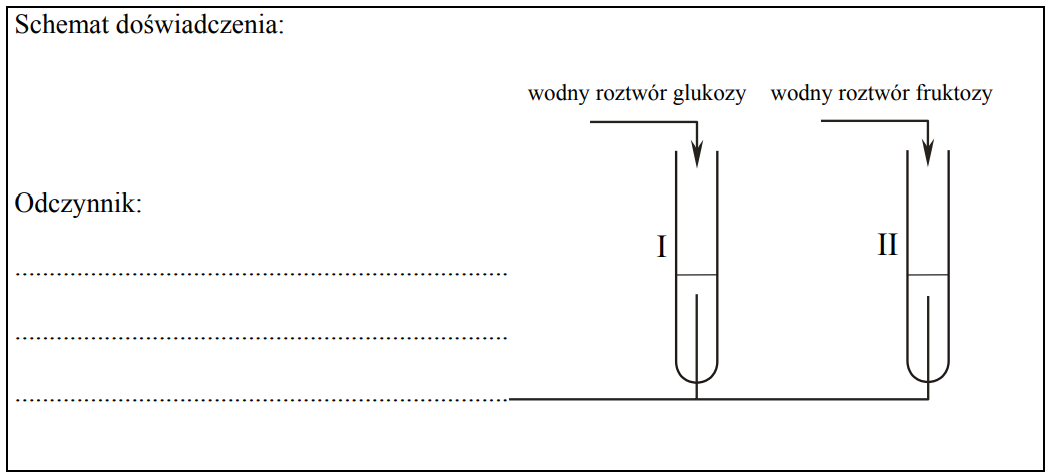
Określanie charakteru chemicznego substancji na podstawie przeprowadzonego doświadczenia. Zadanie 32. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Przeprowadzono doświadczenie zilustrowane poniższym rysunkiem.
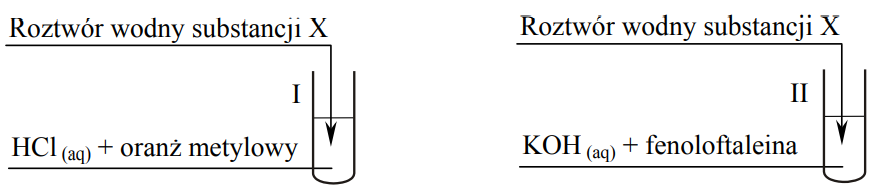
W obu probówkach nastąpiła zmiana barwy wskaźników.
Korzystając z przeprowadzonego doświadczenia, określ charakter chemiczny substancji X.
Wybór właściwego związku chemicznego oraz zapis równań jego reakcji z roztworem kwasu i zasady. Zadanie 33ab. Arkusz CKE chemia maj 2011 rozszerzony (3 punkty)
Przeprowadzono doświadczenie zilustrowane poniższym rysunkiem.
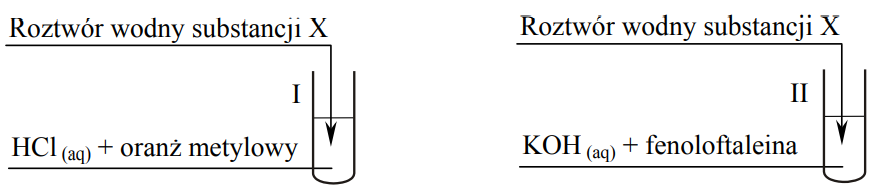
W obu probówkach nastąpiła zmiana barwy wskaźników.
a) Spośród wymienionych związków: benzen, etanol, propanal, kwas aminoetanowy (glicyna) wybierz ten, którego użyto w doświadczeniu jako substancję X, i napisz jego nazwę. b) Napisz w formie jonowej skróconej równania reakcji przebiegających w probówkach I i II. Zastosuj wzory półstrukturalne (grupowe). Probówka I: Probówka II:
Wybór właściwego aminokwasu użytego podczas przeprowadzonego doświadczenia. Zadanie 34. Arkusz CKE chemia maj 2011 rozszerzony (1 punkt)
Pewne reakcje chemiczne, którym ulegają niektóre aminokwasy wchodzące w skład białek, stosuje się jako próby rozpoznawcze na obecność białka. Jedną z takich prób jest reakcja ksantoproteinowa. Przeprowadzono doświadczenie, w którym do znajdującego się w probówce białka jaja kurzego dodano stężony kwas azotowy(V) i zaobserwowano pojawienie się osadu o żółtej barwie.
Spośród podanych poniżej wzorów aminokwasów podkreśl wzór tego, którego obecność w białku spowodowała powstanie żółtego osadu.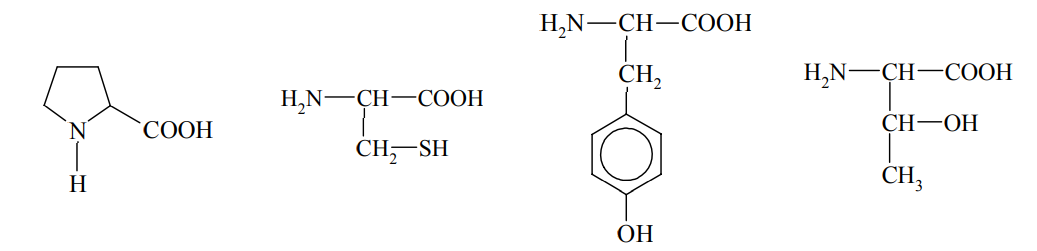
Wybór poprawnych określeń w celu uzyskania prawdziwych zdań dotyczących białek. Zadanie 35. Arkusz CKE chemia maj 2011 rozszerzony (2 punkty)
Uzupełnij poniższe zdania dotyczące właściwości białek, wpisując w odpowiedniej formie gramatycznej określenia wybrane z poniższego zestawu.
denaturacja, wysolenie, roztwór właściwy, roztwór koloidalny, zawiesina, polarne, niepolarne, hydratacja, dysocjacja, odwracalny, nieodwracalny
1. Białko jaja kurzego rozpuszcza się w wodzie, tworząc . Każda cząsteczka białka w roztworze posiada tzw. otoczkę solwatacyjną. Solwatacja cząsteczek białka jest możliwa ze względu na obecność grup hydroksylowych, karboksylowych i aminowych w łańcuchach bocznych aminokwasów. 2. Otoczkę solwatacyjną białek można zniszczyć przez dodanie do roztworu soli, np. NaCl, której jony są silniej solwatowane. Widoczne jest wtedy wytrącenie białka z roztworu, zwane . Proces ten jest . Pod wpływem wysokiej temperatury, soli metali ciężkich czy też stężonych kwasów lub zasad białka wytrącają się z roztworów w sposób . Zjawisko to nosi nazwę .

