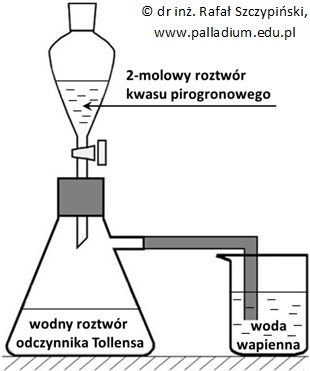
Ocena poprawności zdań dotyczących określonych związków organicznych będących pochodnymi kwasu etanowego
Przeprowadzono doświadczenie chemiczne zilustrowane schematem:
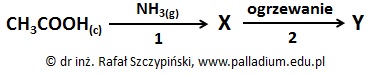
Substancje X oraz Y są związkami organicznymi.
Oceń poprawność poniższych zdań wpisując literę „P” (prawda) lub literę „F” (fałsz). 1. Odczyn wodnego roztworu związku chemicznego X jest praktycznie obojętny. 2. Związek chemiczny X ma budowę jonową i stały stan skupienia w warunkach normalnych. 3. W odpowiednich warunkach ciśnienia i temperatury cząsteczki związku chemicznego Y mogą tworzyć kryształy molekularne. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie ilości wody, jaka pozwoliłaby na rozpuszczenie określonej porcji związku trudno rozpuszczalnego (iloczyn rozpuszczalności)
W temperaturze 25 ⁰C iloczyn rozpuszczalności wodorotlenku magnezu ma wartość 7,94∙10−12, a węglanu wapnia 3,31∙10–9.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Oblicz minimalną objętość wody destylowanej, jaką należałoby dodać do 100 cm3 nasyconego w temperaturze 25 ⁰C roztworu wodorotlenku magnezu, aby możliwe było rozpuszczenie dodatkowej porcji tego związku chemicznego o masie 5,8 mg. Wynik podaj w centymetrach sześciennych, z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie rozpuszczalności wodorotlenku w roztworze o odczynie zasadowym (iloczyn rozpuszczalności)
W temperaturze 25 ⁰C iloczyn rozpuszczalności wodorotlenku magnezu ma wartość 7,94∙10−12, a węglanu wapnia 3,31∙10–9.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Oblicz rozpuszczalność wodorotlenku magnezu w temperaturze 25 ⁰C, w roztworze o wartości pH równej 12. Wynik podaj w μg/dm3 (mikrogramach na decymetr sześcienny roztworu), z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie nazwy systematycznej kwasu karboksylowego oraz wzoru półstrukturalnego jego soli
Kwas szikimowy jest substancją dobrze rozpuszczalną w wodzie, przy czym tylko niewielka jego ilość ulega wówczas dysocjacji elektrolitycznej. Wzór cząsteczki opisanego związku chemicznego można przedstawić w sposób następujący:
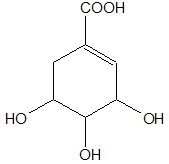
Podaj nazwę systematyczną kwasu szikimowego oraz wzór grupowy produktu jego reakcji z niewielkim nadmiarem wodnego roztworu wodorotlenku sodu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie barwy oraz odczynu roztworu wraz z uzasadnieniem równaniem reakcji chemicznej
Kwas szikimowy jest substancją dobrze rozpuszczalną w wodzie, przy czym tylko niewielka jego ilość ulega wówczas dysocjacji elektrolitycznej. Wzór cząsteczki opisanego związku chemicznego można przedstawić w sposób następujący:

Sporządzono wodny roztwór soli sodowej kwasu szikimowego z dodatkiem oranżu metylowego.
Określ barwę jaką przyjął ten roztwór oraz jaki był jego odczyn? Odpowiedź uzasadnij równaniem odpowiedniej reakcji chemicznej zapisanym w formie jonowej skróconej. Zastosuj wzory grupowe drobin związków organicznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru półstrukturalnego oraz nazwy systematycznej aromatycznego kwasu karboksylowego
Kwas szikimowy jest substancją dobrze rozpuszczalną w wodzie, przy czym tylko niewielka jego ilość ulega wówczas dysocjacji elektrolitycznej. Wzór cząsteczki opisanego związku chemicznego można przedstawić w sposób następujący:

Cząsteczki kwasu szikimowego mają identyczny szkielet węglowy jak cząsteczki aromatycznego kwasu galusowego.
Narysuj wzór półstrukturalny (grupowy) cząsteczki kwasu galusowego i podaj jego nazwę systematyczną. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie przyczyny dobrej rozpuszczalności w wodzie kwasu szikimowego
Kwas szikimowy jest substancją dobrze rozpuszczalną w wodzie, przy czym tylko niewielka jego ilość ulega wówczas dysocjacji elektrolitycznej. Wzór cząsteczki opisanego związku chemicznego można przedstawić w sposób następujący:

Wyjaśnij, dlaczego kwas szikimowy jest związkiem chemicznym dobrze rozpuszczalnym w wodzie? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie, czy strąci się osad substancji trudno rozpuszczalnej (iloczyn rozpuszczalności)
Iloczyn rozpuszczalności jest wielkością opisującą równowagę dynamiczną, jaka ustala się między osadem substancji trudno rozpuszczalnej, a jej nasyconym roztworem. W tabeli zebrano dane na temat wartości iloczynów rozpuszczalności trzech soli baru w temperaturze 25 ⁰C.
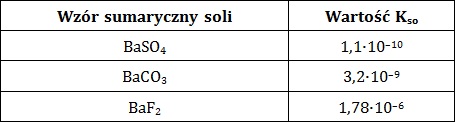
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Uzasadnij (wykonując stosowne obliczenia), czy strąci się osad węglanu baru, jeśli w temperaturze 25 ⁰C zmieszamy ze sobą 10 cm3 0,001-molowego roztworu chlorku baru z 15 cm3 0,002-molowego roztworu węglanu potasu? Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy związku chemicznego, jaką można rozpuścić w roztworze zawierającym wspólny jon (iloczyn rozpuszczalności)
Iloczyn rozpuszczalności jest wielkością opisującą równowagę dynamiczną, jaka ustala się między osadem substancji trudno rozpuszczalnej, a jej nasyconym roztworem. W tabeli zebrano dane na temat wartości iloczynów rozpuszczalności trzech soli baru w temperaturze 25 ⁰C.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Oblicz masę fluorku baru, jaką można rozpuścić w 100 cm3 roztworu azotanu(V) baru o stężeniu równym 0,005 mol∙dm–3 w temperaturze 25 ⁰C. Wynik podaj w miligramach, z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie liczby jonów w nasyconym roztworze trudno rozpuszczalnego związku chemicznego (iloczyn rozpuszczalności)
Iloczyn rozpuszczalności jest wielkością opisującą równowagę dynamiczną, jaka ustala się między osadem substancji trudno rozpuszczalnej, a jej nasyconym roztworem. W tabeli zebrano dane na temat wartości iloczynów rozpuszczalności trzech soli baru w temperaturze 25 ⁰C.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Oblicz liczbę jonów pochodzących z dysocjacji siarczanu(VI) baru, jakie znajdują się w 500 cm3 nasyconego w temperaturze 25 ⁰C wodnego roztworu tej soli. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone