Wyjaśnienie przyczyny większej rozpuszczalności w wodzie amoniaku, niż dwutlenku węgla (rozpuszczalność substancji)
W tabeli zebrano dane na temat rozpuszczalności w wodzie amoniaku i tlenku węgla(IV) pod ciśnieniem równym 1013 hPa w różnych temperaturach.
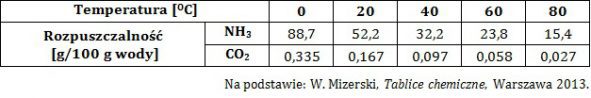
Wyjaśnij, dlaczego jeden z wymienionych gazów jest lepiej rozpuszczalny w wodzie od drugiego z nich? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena poprawności zdań dotyczących rozpuszczalności tlenku węgla(IV) oraz amoniaku (rozpuszczalność substancji)
W tabeli zebrano dane na temat rozpuszczalności w wodzie amoniaku i tlenku węgla(IV) pod ciśnieniem równym 1013 hPa w różnych temperaturach.

Oceń poprawność poniższych zdań dotyczących rozpuszczalności amoniaku oraz tlenku węgla(IV) wpisując literę „P” (prawda) lub literę „F” (fałsz). 1. W warunkach normalnych równe objętości obu gazów mają taką samą rozpuszczalność. 2. W roztworze o odczynie zasadowym możliwe będzie rozpuszczenie jeszcze większej ilości tlenku węgla(IV), natomiast rozpuszczalność amoniaku będzie mniejsza. 3. Niższa temperatura wody sprzyja rozpuszczaniu w niej obu gazów. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Przeliczanie rozpuszczalności siarczanu(VI) amonu z masy na liczbę moli w jednostce objętości wody
W temperaturze 20 oC rozpuszczalność siarczanu(VI) amonu ma wartość 75,2 g/100 g wody.
Oblicz z dokładnością do pierwszego miejsca po przecinku, ile moli tej soli można rozpuścić w 1 dm3 wody w opisanych warunkach? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie rozpuszczalności siarczanu(VI) potasu na podstawie podanej masy wody oraz soli (rozpuszczalność substancji)
Do 80 g wody destylowanej wprowadzono 8,8 g bezwodnego siarczanu(VI) potasu. Zawartość naczynia dokładnie wymieszano uzyskując nasycony w temperaturze 20 oC roztwór soli.
Oblicz rozpuszczalność siarczanu(VI) potasu w podanych warunkach. Wynik wyraź w gramach na 100 g wody z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie rozpuszczalności dwuchromianu(VI) potasu na podstawie masy roztworu oraz substancji rozpuszczonej (rozpuszczalność substancji)
Nasycony w temperaturze 20 oC roztwór dwuchromianu(VI) potasu ma masę 56,1 g i zawiera 6,1 g substancji rozpuszczonej.
Oblicz z dokładnością do trzech cyfr znaczących rozpuszczalność (g/100 g wody) dwuchromianu(VI) potasu w podanej temperaturze. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy wody w podanej masie nasyconego roztworu mocznika (rozpuszczalność substancji)
W temperaturze 20 oC rozpuszczalność mocznika wynosi 108 g/100 g wody destylowanej.
Oblicz, jaką masę wody zawierają 52 g nasyconego w podanej temperaturze wodnego roztworu mocznika? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie rozpuszczalności glicyny na podstawie objętości rozpuszczalnika oraz masy nasyconego roztworu (rozpuszczalność substancji)
Do 0,4 dm3 wody destylowanej wprowadzono glicynę i w temperaturze 40 oC uzyskano 532,8 g nasyconego roztworu aminokwasu.
Oblicz rozpuszczalność glicyny w opisanych warunkach. Wynik podaj w g/100 g wody z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia procentowego nasyconego roztworu chlorku sodu o znanej rozpuszczalności (rozpuszczalność substancji)
Rozpuszczalność chlorku sodu w temperaturze 80 oC wynosi 38 g/100 g wody.
Oblicz stężenie procentowe nasyconego w tej temperaturze roztworu podanej soli. Wynik podaj z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie rozpuszczalności azotanu(V) sodu na podstawie stężenia procentowego nasyconego roztworu (rozpuszczalność substancji)
W temperaturze 40 oC nasycony wodny roztwór azotanu(V) sodu ma stężenie 51%.
Oblicz rozpuszczalność (g/100 g wody) tej soli w podanych warunkach. Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie jaki procent masy wyjściowego roztworu stanowi przesącz uzyskany w wyniku odparowania wody i wykrystalizowania bezwodnego chlorku potasu
W temperaturze 80 oC rozpuszczalność bezwodnego chlorku potasu wynosi 51,2 g/100 g wody. Z 300 g nasyconego w tej temperaturze roztworu odparowano 25 g wody, a powstały osad odsączono.
Oblicz, jaki procent masy wyjściowego roztworu stanowił przesącz, jeśli wiadomo, że wykrystalizowana sól nie była hydratem? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzoru grupowego laktamu na podstawie nazwy aminokwasu
W odpowiednich warunkach niektóre aminokwasy wykazują zdolność do tworzenia cyklicznych amidów zwanych laktamami. Przykładem takiej substancji jest związek o nazwie kwas 4-metylo-5-aminopentanowy.
Narysuj wzór grupowy cząsteczki jego laktamu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości roztworu wodorotlenku niezbędnej do zobojętnienia nasyconego roztworu kwasu solnego
Rysunek poniżej ilustruje charakterystyki zmian rozpuszczalności chlorowodoru oraz azotanu(V) ołowiu(II) w 100 g wody, w zakresie temperatur 0 ⁰C ÷ 100 ⁰C, pod ciśnieniem 1013 hPa.
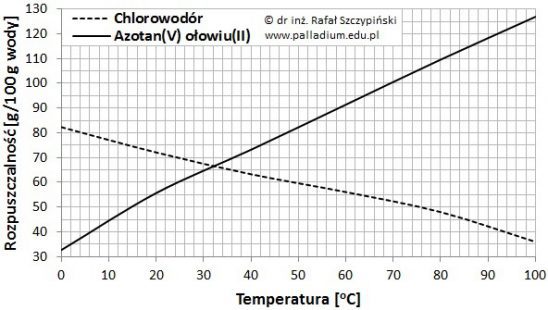
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Przygotowano nasycony w temperaturze 24 ⁰C roztwór kwasu solnego o masie 68 g.
Oblicz, jaką objętość 2,3-molowego roztworu wodorotlenku potasu należy użyć, w celu zobojętnienia podanego roztworu kwasu solnego? Wynik podaj w centymetrach sześciennych, stosując przybliżenie do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie objętości wody, jaką należy wprowadzić do mieszaniny, w celu uzyskania roztworu nasyconego (rozpuszczalność substancji)
Rysunek poniżej ilustruje charakterystyki zmian rozpuszczalności chlorowodoru oraz azotanu(V) ołowiu(II) w 100 g wody, w zakresie temperatur 0 ⁰C ÷ 100 ⁰C, pod ciśnieniem 1013 hPa.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W temperaturze równej 36 ⁰C przygotowano mieszaninę złożoną z 35 g azotanu(V) ołowiu(II) oraz 40 g wody destylowanej.
Oblicz, ile cm3 wody należałoby dodatkowo wprowadzić do tej mieszaniny, aby w podanej temperaturze uzyskać roztwór nasycony? Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie dodatkowej ilości substancji, jaką należy rozpuścić, aby uzyskać roztwór nasycony (rozpuszczalność substancji)
Rysunek poniżej ilustruje charakterystyki zmian rozpuszczalności chlorowodoru oraz azotanu(V) ołowiu(II) w 100 g wody, w zakresie temperatur 0 ⁰C ÷ 100 ⁰C, pod ciśnieniem 1013 hPa.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W temperaturze 25 ⁰C przygotowano 250 gramów 25-procentowego roztworu azotanu(V) ołowiu(II).
Oblicz, jaką masę soli należy wprowadzić do tego roztworu, aby po jej rozpuszczeniu, w temperaturze 25 ⁰C uzyskać roztwór nasycony? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy wykrystalizowanej soli w wyniku ochładzania roztworu (rozpuszczalność substancji)
Rysunek poniżej ilustruje charakterystyki zmian rozpuszczalności chlorowodoru oraz azotanu(V) ołowiu(II) w 100 g wody, w zakresie temperatur 0 ⁰C ÷ 100 ⁰C, pod ciśnieniem 1013 hPa.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W temperaturze równej 42 ⁰C sporządzono 300 g nasyconego roztworu azotanu(V) ołowiu(II).
Oblicz, jaka masa soli wykrystalizuje po ochłodzeniu tego roztworu o 20 ⁰C? Określ, czy proces ten jest reakcją chemiczną, czy zjawiskiem fizycznym – uzasadnij swoją odpowiedź. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

