Rysowanie wzoru grupowego cząsteczki karbocysteiny ze wskazaniem liczby atomów węgla o określonym modelu hybrydyzacji
Substancją czynną wchodzącą w skład leków stosowanych w objawowym leczeniu chorób układu oddechowego przebiegających z nadmiernym wytwarzaniem gęstej i lepkiej wydzieliny oskrzelowej jest karbocysteina. Cząsteczka tego kwasowego aminokwasu, zbudowana jest z reszty cząsteczki cysteiny oraz reszty cząsteczki kwasu etanowego połączonych za pośrednictwem atomu siarki. Inną pochodną cysteiny o zbliżonym do karbocysteiny działaniu leczniczym jest związek chemiczny o nazwie N-acetylocysteina, w cząsteczkach której rozróżnia się wiązanie amidowe. Wodne roztwory N-acetylocysteiny mają od-czyn kwasowy.
Na podstawie: D. Steinhilber i inni, Chemia medyczna. Cele leków, substancje czynne, biologia chemiczna, Wrocław 2012.
Narysuj wzór półstrukturalny (grupowy) cząsteczki karbocysteiny, a następnie określ liczbę atomów węgla w jej cząsteczce, których orbitalom walencyjnym można przypisać hybrydyzację typu sp3. Wzór cząsteczki karbocysteiny: Liczba atomów węgla o hybrydyzacji sp3: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzorów grupowych cząsteczek oraz jonów powstałych w wyniku hydrolizy kwasowej oraz zasadowej N-acetylocysteiny
Substancją czynną wchodzącą w skład leków stosowanych w objawowym leczeniu chorób układu oddechowego przebiegających z nadmiernym wytwarzaniem gęstej i lepkiej wydzieliny oskrzelowej jest karbocysteina. Cząsteczka tego kwasowego aminokwasu, zbudowana jest z reszty cząsteczki cysteiny oraz reszty cząsteczki kwasu etanowego połączonych za pośrednictwem atomu siarki. Inną pochodną cysteiny o zbliżonym do karbocysteiny działaniu leczniczym jest związek chemiczny o nazwie N-acetylocysteina, w cząsteczkach której rozróżnia się wiązanie amidowe. Wodne roztwory N-acetylocysteiny mają od-czyn kwasowy.
Na podstawie: D. Steinhilber i inni, Chemia medyczna. Cele leków, substancje czynne, biologia chemiczna, Wrocław 2012.
Narysuj wzory półstrukturalne cząsteczek oraz jonów organicznych produktów powstałych w wyniku hydrolizy kwasowej oraz hydrolizy zasadowej N-acetylocysteiny. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzorów elektronowych cząsteczek dwóch tlenków azotu oraz określanie ich polarności
Cząsteczki, w obrębie których niesymetrycznie rozłożony jest ładunek elektryczny mają budowę polarną. Opisany warunek spełniają niektóre tlenki azotu.
Wiedząc, że w cząsteczkach N2O3 oraz N2O4 jedno z wiązań sigma utworzone jest między atomami azotu, narysuj wzory elektronowe kreskowe obu tych drobin i określ ich polarność. W tym celu uzupełnij tabelę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzoru elektronowego cząsteczki ozonu oraz określanie jej polarności
Ozon (O3) jest odmianą alotropową tlenu. Struktura jego cząsteczki jest podobna do struktury cząsteczki tlenku siarki(IV).
Narysuj wzór elektronowy kreskowy cząsteczki ozonu, a następnie wpisz słowo TAK lub słowo NIE w odpowiedniej rubryce tabeli, oceniając w ten sposób, czy cząsteczka tego gazu ma budowę polarną? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone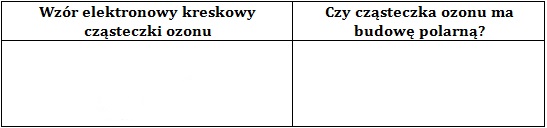
Rysowanie wzorów elektronowych kreskowych cząsteczek związków chemicznych
Poniżej podano wzory sumaryczne cząsteczek kilku związków chemicznych:
PCl3, SO2, BeCl2, BBr3, SbH3, SO3, CCl4, CO2, SiH4 oraz H2O.
Narysuj wzory elektronowe kreskowe cząsteczek, których wzory sumaryczne przedstawione zostały w informacji wprowadzającej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie relacji matematycznych między wartościami momentów dipolowych cząsteczek
Poniżej podano wzory sumaryczne cząsteczek kilku związków chemicznych:
PCl3, SO2, BeCl2, BBr3, SbH3, SO3, CCl4, CO2, SiH4 oraz H2O.
W wolne pola znajdujące się pomiędzy wzorami sumarycznymi poniższych związków chemicznych wstaw odpowiedni znak „>”, „<” lub „=” opisujący właściwą relację matematyczną, jaka zachodzi między wartościami momentów dipolowych ich cząsteczek. PCl3 …….. SO3 BeCl2 …….. BBr3 SbH3 …….. SO3 CCl4 …….. CO2 SiH4 …….. H2O Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Przypisywanie substancji do typu kryształów jakie tworzy
Krystaliczne ciała stałe to ciała stałe, w których atomy, jony lub cząsteczki rozmieszczone są w sposób uporządkowany. Poniżej podano przykłady kilku substancji chemicznych, które w temperaturze 25 oC, pod ciśnieniem normalnym są ciałami stałymi:
BaO, NH4Cl, SiO2, diament, α-D-glukoza, siarka, CaCO3.
Przypisz wymienione substancje chemiczne do właściwych typów kryształów. Kryształy jonowe: Kryształy kowalencyjne: Kryształy molekularne: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Przypisywanie typu wiązania w substancji chemicznej - niklu oraz tlenku węgla(II)
W temperaturze pokojowej tlenek węgla(II) reaguje z niklem tworząc związek chemiczny o nazwie tetrakarbonylek niklu:
Ni(s) + 4CO(g) → Ni(CO)4(g)
Opisany produkt reakcji to lotna, trująca substancja, która pod ciśnieniem normalnym wrze w temperaturze 43 oC. W odpowiednich warunkach tetrakarbonylek niklu występuje w postaci krystalicznej. Każdy atom niklu połączony jest wtedy z czterema ligandami CO.
Na podstawie: P. W. Atkins, L. Jones, Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2018.
Określ typy wiązań chemicznych (metaliczne, kowalencyjne, kowalencyjne spolaryzowane, jonowe), jakie występują w obrębie substratów opisanej przemiany. Nikiel: Tlenek węgla(II): © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Uszeregowanie drobin według rosnącej wartości kąta między wiązaniami
Ponieważ wolne pary elektronowe zajmują większą przestrzeń i wykazują większą siłę odpychania niż wiążące pary elektronowe, prowadzi to do różnych kątów między wiązaniami w wielu cząsteczkach lub jonach, pomimo, że zawierają one często atom centralny o tym samym modelu hybrydyzacji orbitali walencyjnych.
Na podstawie: K.-H. Lautenschläger i inni, Nowoczesne kompendium chemii, Warszawa 2018.
Dany jest zbiór cząsteczek oraz jonów: PH3, H2O, HCN, BF3 oraz SO42–.
Uszereguj podane drobiny zgodnie ze wzrastającą wartością kąta między ich wiązaniami. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone