Przypisywanie obserwacji do przeprowadzonego eksperymentu
Przeprowadzono doświadczenie chemiczne z udziałem oleju rzepakowego, stearyny oraz benzyny. Zawartość probówki z substancją stałą była ogrzewana, ale dopiero po dodaniu do niej drugiego odczynnika.
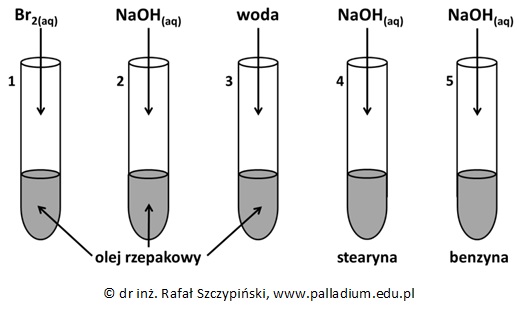
Po dodaniu stechiometrycznej ilości drugiego z odczynników, zawartością każdej z probówek energicznie wstrząśnięto.
Napisz, co zaobserwowano w probówkach z olejem rzepakowym do których dodano drugi odczynnik i wstrząśnięto ich zawartością? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania procesu, którego przebieg spowodował określone zabarwienie mieszaniny poreakcyjnej z fenoloftaleiną
Przeprowadzono doświadczenie chemiczne z udziałem oleju rzepakowego, stearyny oraz benzyny. Zawartość probówki z substancją stałą była ogrzewana, ale dopiero po dodaniu do niej drugiego odczynnika.

Po dodaniu stechiometrycznej ilości drugiego z odczynników, zawartością każdej z probówek energicznie wstrząśnięto. Do pozostałej w czwartej probówce mieszaniny poreakcyjnej dodano kilka kropli fenoloftaleiny i zaobserwowano pojawienie się malinowego zabarwienia roztworu.
Napisz w formie jonowej skróconej równania reakcji chemicznych, jakie odpowiadają za wyżej podane zabarwienie roztworu. Uwzględnij związki chemiczne będące pochodnymi składników stearyny. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyjaśnienie przynależności związku chemicznego do anionowych środków powierzchniowo czynnych
Igepon A to syntetyczny anionowy środek powierzchniowo czynny, zawierający reszty kwasów – oleinowego oraz 2-hydroksyetanosulfonowego. Opisany związek chemiczny można przedstawić wzorem C17H33COOCH2CH2SO3–Na⁺.
Wyjaśnij, dlaczego Igepon A nie jest zaliczany do kationowych, lecz do anionowych środków powierzchniowo czynnych? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji chemicznej na podstawie informacji wprowadzającej
Igepon A to syntetyczny anionowy środek powierzchniowo czynny, zawierający reszty kwasów – oleinowego oraz 2-hydroksyetanosulfonowego. Opisany związek chemiczny można przedstawić wzorem C17H33COOCH2CH2SO3–Na⁺.
W środowisku silnej zasady Igepon A jest nietrwały i łatwo ulega wówczas rozkładowi z utworzeniem dwóch związków chemicznych o charakterze soli.
Napisz w formie jonowej skróconej równanie opisanej reakcji chemicznej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH miareczkowanego roztworu wodorotlenku baru w określonym momencie miareczkowania (miareczkowanie)
Punktem równoważnikowym miareczkowania określa się moment, w którym analit przereagował ilościowo z dodanym z biurety titrantem. Roztwór wodorotlenku baru o objętości równej 50 cm3 miareczkowano 0,35-molowym roztworem kwasu solnego wobec błękitu bromotymolowego jako wskaźnika. Punkt równoważnikowy osiągnięto w momencie wykorzystania dokładnie 40 cm3 roztworu titranta.
Jaka była wartość pH miareczkowanego roztworu w momencie zobojętnienia połowy początkowej liczby jonów wodorotlenkowych, pochodzących z dysocjacji elektrolitycznej zasady barowej? Wynik podaj z dokładnością do dwóch cyfr znaczących. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone