Obliczanie stężenia masowego kationów w wodnym roztworze soli sodowej fluoresceiny
Stężenie masowe definiuje się jako masę substancji rozpuszczonej, jaka przypada na określoną jednostkę objętości roztworu.
Na podstawie: D. Mickiewicz, Podstawy obliczeń chemicznych. Część pierwsza, Łódź 2019.
Przez kanalik układu mikroprzepływowego przepływa wodny roztwór soli sodowej fluoresceiny (M = 376 g/mol) o stężeniu masowym równym 0,001 mg∙ml-1. Schemat struktury opisanego związku chemicznego przedstawia rysunek poniżej.
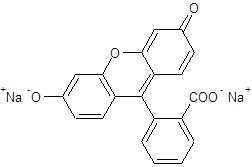
Oblicz stężenie kationów sodu w roztworze opisanym w informacji wprowadzającej. Wynik podaj w ng∙ml-1 (nanogramach na mililitr) z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego kationów w wodnym roztworze soli sodowej fluoresceiny
Stężenie masowe definiuje się jako masę substancji rozpuszczonej, jaka przypada na określoną jednostkę objętości roztworu.
Na podstawie: D. Mickiewicz, Podstawy obliczeń chemicznych. Część pierwsza, Łódź 2019.
Przez kanalik układu mikroprzepływowego przepływa wodny roztwór soli sodowej fluoresceiny (M = 376 g/mol) o stężeniu masowym równym 0,001 mg∙ml-1. Schemat struktury opisanego związku chemicznego przedstawia rysunek poniżej.

Oblicz stężenie molowe kationów sodu w roztworze opisanym w informacji wprowadzającej. Wynik podaj w μmol∙dm-3 (mikromolach na decymetr sześcienny) z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy roztworu sacharydu zawierającego taką samą ilość cukru co roztwór o innym stężeniu
Rysunek poniżej przedstawia wzory chemiczne cząsteczek laktozy oraz celobiozy:
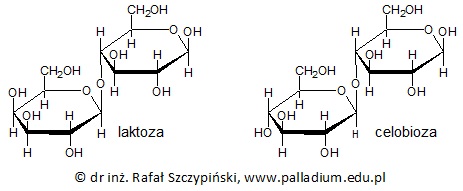
Zawartość laktozy w mleku krowim stanowi około 4,6% jego masy, natomiast w mleku karmiących matek 7%.
Oblicz masę mleka krowiego, w jakiej zawarta jest taka sama ilość laktozy, co w 75 g mleka karmiących matek. Wynik podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie niezbędnej do przeprowadzenia reakcji chemicznej objętości powietrza
Antymon może występować w tzw. żółtej postaci tworząc kilkuatomowe cząsteczki. Taką odmianę alotropową antymonu otrzymuje się w reakcji jego wodorku o wzorze SbH3 (antymonowodoru) z ciekłym tlenem, przy czym stosunek molowy powstałych produktów reakcji (antymonu oraz wody) wynosi odpowiednio 1:6.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Jakiej objętości powietrza odmierzonego w warunkach normalnych należy użyć, w celu uzyskania 61 g antymonu? Wynik obliczeń podaj z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie zawartości pierwiastka w próbce mieszaniny użytej do reakcji chemicznej
W celu oczyszczenia próbki srebra zanieczyszczonej tlenkami ZnO oraz CuO, w jednym z etapów procesu poddaje się ją działaniu nadmiaru roztworu kwasu solnego. W wyniku działania kwasu solnego na próbkę zanieczyszczonego srebra powstał roztwór zawierający 13,6 g chlorku cynku oraz 6,75 g chlorku miedzi(II).
Oblicz liczbę atomów srebra w próbce, jeśli wymienione zanieczyszczenia stanowiły 20% jej masy. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy powstałego tlenku azotu(IV) na podstawie znanej masy oraz objętości mieszaniny substratów
Reakcja utleniania tlenku azotu(II) ozonem przebiega zgodnie z równaniem:
NO + O3 → NO2 + O2
Oblicz, jaką masę tlenku NO2 otrzymano, jeśli przygotowana mieszanina substratów o masie 32,4 g w temperaturze 303 K i pod ciśnieniem 1007 hPa zajmowała objętość 20 dm3? Przyjmij, że uniwersalna stała gazowa ma wartość 83,1 hPa∙dm3∙mol–1∙K–1. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru półstrukturalnego oraz nazwy systematycznej estru
Najprostszy alkohol aromatyczny i produkt jego reakcji z nadmiarem zakwaszonego roztworu manganianu(VII) potasu tworzą ester, którego cząsteczki mają jeden atom węgla o hybrydyzacji orbitali walencyjnych typu sp3. Jednym z produktów reakcji jego hydrolizy w wodnym roztworze wodorotlenku potasu jest popularny konserwant żywności.
Podaj wzór półstrukturalny oraz nazwę opisanego estru. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone