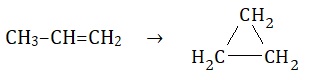Gęstość tlenku węgla(IV) w określonych warunkach (równanie Clapeyrona)
Tlenek węgla(IV) to bezbarwny, bezwonny gaz o wzorze sumarycznym CO2.
Oblicz gęstość tlenku węgla(IV) w temperaturze równej 25 ⁰C pod ciśnieniem 998 hPa. Wynik podaj z dokładnością do drugiego miejsca po przecinku. Przyjmij, że uniwersalna stała gazowa ma wartość równą 83,1 hPa∙dm3∙mol–1∙K–1. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Objętość próbki ozonu o określonej masie (równanie Clapeyrona)
Ozon (O3) jest odmianą alotropową tlenu, bladoniebieskim gazem o duszącej woni.
Oblicz objętość próbki ozonu o masie 2,4 kg tego gazu odmierzonego w temperaturze 15 ⁰C pod ciśnieniem 990 hPa. Wynik podaj w decymetrach sześciennych z dokładnością do cyfry jedności. Przyjmij, że uniwersalna stała gazowa ma wartość równą 83,1 hPa∙dm3∙mol–1∙K–1. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie liczby atomów w cząsteczce ozonu (warunki normalne)
Ozon w warunkach normalnych jest gazem o gęstości 2,14 g·dm–3.
Oblicz, z ilu atomów tlenu składa się cząsteczka ozonu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie liczby atomów w cząsteczce fosforu (równanie Clapeyrona)
W temperaturze równej 485 ⁰C, pod ciśnieniem 1016 hPa pary fosforu mają gęstość równą 2 g·dm–3.
Oblicz z ilu atomów składają się cząsteczki fosforu w stanie pary? Przyjmij, że uniwersalna stała gazowa ma wartość równą 83,1 hPa∙dm3∙mol–1∙K–1. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie wzoru węglowodoru na podstawie opisu struktury jego cząsteczki oraz właściwości
W cząsteczce pewnego węglowodoru łańcuchowego wszystkie atomy węgla są równocenne. Związek ten nie odbarwia zakwaszonego roztworu manganianu(VII) potasu, a w warunkach normalnych jest gazem.
Narysuj wzór grupowy tego węglowodoru. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie nowej pojemności reaktora, w którym znajduje się gaz po zmianie ciśnienia w stałej temperaturze
Zgodnie z prawem Boyle’a, w stałej temperaturze ciśnienie próbki gazu jest odwrotnie proporcjonalne do jego objętości.
Na podstawie: P. W. Atkins, Chemia fizyczna, Warszawa 2012.
W pewnej temperaturze T, w reaktorze o pojemności 12 dm3 znajduje się taka liczba moli gazu, że jego ciśnienie wynosi 2195 hPa.
Oblicz, jaka powinna być pojemność reaktora, aby w tej samej temperaturze T opisana ilość gazu miała ciśnienie odpowiadające normalnemu? Wynik podaj w dm3 z dokładnością do cyfry jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Masa chlorku wapnia zawierająca tyle samo drobin, co masa innego związku chemicznego
Chlorek wapnia (CaCl2) jest związkiem chemicznym o budowie jonowej, natomiast dwutlenek węgla (CO2) ma budowę kowalencyjną.
Oblicz, w jakiej masie chlorku wapnia znajduje się tyle samo anionów chlorkowych, co cząsteczek dwutlenku węgla w próbce tego gazu o masie 550 mg. Wynik podaj w miligramach, stosując przybliżenie do trzech cyfr znaczących. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Objętość dibromometanu zawierająca tyle samo atomów bromu, co jonów potasu objętość innego związku chemicznego
W temperaturze 25 ⁰C pod ciśnieniem 1013 hPa cyjanek potasu (KCN) jest ciałem stałym o gęstości równej 1,52 g·cm–3, a dibromometan (CH2Br2) to ciecz o gęstości 2,48 g·cm–3.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Oblicz, w jakiej objętości dibromometanu znajduje się taka sama liczba atomów bromu, co liczba jonów potasu w 5 cm3 cyjanku potasu? Wynik podaj w centymetrach sześciennych z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Objętość cyjanku potasu zawierająca tyle samo drobin, co objętość innego związku chemicznego
W temperaturze 25 ⁰C pod ciśnieniem 1013 hPa cyjanek potasu (KCN) jest ciałem stałym o gęstości równej 1,52 g·cm–3, a dibromometan (CH2Br2) to ciecz o gęstości 2,48 g·cm–3.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Oblicz objętość próbki cyjanku potasu, w której znajduje się taka sama liczba moli jonów, co liczba moli cząsteczek dibromometanu w probówce zawierającej 5 cm3 tej substancji, w podanych w informacji wprowadzającej warunkach. Wynik podaj w centymetrach sześciennych z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Liczba cząsteczek odpowiadająca liczbie jonów
Siarkowodór (H2S) jest związkiem chemicznym, który w przeciwieństwie do węglanu sodu (Na2CO3) nie ma budowy jonowej.
Oblicz, w jakiej objętości siarkowodoru (warunki normalne) znajduje się tyle samo cząsteczek, co łącznie jonów w 53 mg węglanu sodu? Wynik podaj w cm3, stosując przybliżenie do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena poprawności zdania wraz z uzasadnieniem dotyczącego reakcji substytucji rodnikowej z udziałem 2,2,4-trimetylopentanu
Podstawienie atomu wodoru atomem chloru w cząsteczkach alkanów podczas reakcji substytucji rodnikowej przebiega tym łatwiej, im wyższa jest rzędowość atomu węgla z jakim połączony jest podstawiany atom wodoru.
Oceń, czy zapisane poniżej zdanie jest prawdziwe. Uzasadnij odpowiedź. W wyniku reakcji monochlorowania 2,2,4-trimetylopentanu w obecności światła, najłatwiej powstającym produktem organicznym jest czwartorzędowa chloropochodna alkilowa. Ocena: Uzasadnienie: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie liczby produktów monochlorowania 2,2,4-trimetylopentanu w obecności światła
Podstawienie atomu wodoru atomem chloru w cząsteczkach alkanów podczas reakcji substytucji rodnikowej przebiega tym łatwiej, im wyższa jest rzędowość atomu węgla z jakim połączony jest podstawiany atom wodoru.
W wyniku chlorowania 2,2,4-trimetylopentanu w obecności światła powstaje kilka monochloropochodnych alkilowych.
Ustal liczbę takich związków chemicznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Objętość amoniaku zawierająca tyle samo drobin, co anionów masa innego związku chemicznego
Amoniak (NH3) jest bezbarwnym gazem, o charakterystycznej drażniącej woni, natomiast tlenek potasu (K2O) to białe ciało stałe.
Oblicz, w jakiej objętości (warunki normalne) amoniaku znajduje się tyle samo cząsteczek, co anionów tlenkowych w 4,7 g próbki tlenku potasu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Masa kwasu ortofosforowego(V) zawierająca łącznie tyle samo drobin, co masa innego związku chemicznego
Kwas ortofosforowy(V) o wzorze H3PO4 stosuje się jako odrdzewiacz do stali, a jego sól – ortofosforan(V) sodu, czyli Na3PO4 jest regulatorem kwasowości dodawanym do żywności.
Oblicz, w jakiej masie kwasu ortofosforowego(V) znajduje się tyle samo cząsteczek, co łącznie jonów w 4,1 g ortofosforanu(V) sodu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone