TEMAT XIX. Wykład: biocząsteczki, część 2 – cukry, glikozydy
Film podzielony jest na rozdziały. Możesz wybrać dowolny z nich, klikając na pasek postępu w odtwarzaczu.
0:00 Wstęp
0:19 Systematyka węglowodanów
2:38 Ogólna budowa cząsteczek monosacharydów, szeregi konfiguracyjne
5:27 Izomeria optyczna aldoz
7:39 Izomeria aldoz względem ketoz, pojęcie epimerii
9:39 Wzory Hawortha, postać piranozowa oraz furanozowa, anomeryczny atom węgla
12:32 Rozpoznawanie wzoru Hawortha aldozy oraz ketozy
14:15 Przekształcanie wzoru Hawortha w projekcję Fischera aldozy
17:34 Przekształcanie wzoru Hawortha w projekcję Fischera ketozy
20:27 Mutarotacja
23:46 Właściwości redukujące aldoz oraz ketoz wobec odczynników Trommera i Tollensa
26:19 Przebieg próby Trommera z udziałem monosacharydu
28:05 Przebieg próby Tollensa z udziałem monosacharydu
29:43 Odróżnianie aldoz od ketoz
32:09 Pozostałe reakcje monosacharydów
35:25 Właściwości fizykochemiczne glukozy oraz jej otrzymywanie
37:47 Inne cukry proste: ryboza, deoksyryboza, galaktoza
38:04 Enancjomery monosacharydów
38:53 Glikozydy – budowa cząsteczek
40:43 Klasyfikacja glikozydów
42:23 Nukleotydy
44:21 Disacharydy redukujące i nieredukujące – struktura cząsteczek
46:58 Sacharoza – budowa oraz właściwości
48:54 Przebieg prób Trommera i Tollensa z udziałem disacharydu nieredukującego
50:52 Hydroliza sacharozy oraz towarzysząca temu zmiana skręcalności właściwej roztworu
53:51 Wykrywanie produktów reakcji hydrolizy disacharydu nieredukującego
56:38 Budowa i właściwości laktozy
1:00:00 Budowa i właściwości maltozy oraz celobiozy
1:02:44 Budowa i właściwości skrobi. Amyloza oraz amylopektyna
1:06:30 Doświadczalne wykrywanie skrobi
1:08:33 Budowa i właściwości celulozy
1:10:11 Syntetyczne pochodne celulozy – azotan celulozy oraz octan celulozy
Pewnym rozszerzeniem wykładu są dostępne pod poniższymi linkami artykuły:
1. Drewno, celuloza i wiązania wodorowe.
Czas trwania wykładu: 1 godzina 12 minut 48 sekund. Forma wykładu: film – prezentacja multimedialna z lektorem (Rafał Szczypiński).
TEMAT XX. Wykład: podstawy spektroskopii oraz widma
Przed obejrzeniem lekcji należy zapoznać się z tutorialem:
Które atomy węgla oraz wodoru są równocenne?
Film podzielony jest na rozdziały. Możesz wybrać dowolny z nich, klikając na pasek postępu w odtwarzaczu.
0:00 Wstęp
1:24 Absorpcja promieniowania elektromagnetycznego
4:16 Absorbancja i transmitancja
8:39 Zależność absorbancji od stężenia, prawo Lamberta-Beera
13:38 Fluorescencja, zależność natężenia fluorescencji od stężenia
19:35 Widmo UV-Vis (absorpcyjne)
22:07 Czynniki wpływające na przesunięcie pasma absorpcji
25:07 Spektroskopia NMR
28:00 Widmo 1H NMR, pojęcie przesunięcia chemicznego
33:21 Pojęcie multipletowości sygnałów w widmie 1H NMR
35:23 Rozszczepienie sygnałów w widmie 1H NMR
42:21 Brak rozszczepienia sygnałów w widmie 1H NMR
48:21 Ustalanie liczby atomów wodoru na podstawie widma 1H NMR, integracja
51:18 Widmo 13C NMR
52:31 Widmo MS (spektrometria mas)
55:54 Spektroskopia w podczerwieni (IR)
Czas trwania wykładu: 1 godzina 1 minuta 42 sekundy. Forma wykładu: film – prezentacja multimedialna z lektorem (Rafał Szczypiński).
Tutorial: równania opisujące szybkość reakcji chemicznej
W filmie omówiony został sens fizyczny dwóch wyrażeń opisujących szybkość reakcji chemicznych – w tym równanie kinetyczne.
Tutorial: jak działa wskaźnik alkacymetryczny?
W filmie omówiona została zasada działania wskaźników alkacymetrycznych stosowanych podczas miareczkowania.
Tutorial: jak dobrać wskaźnik alkacymetryczny?
W filmie omówione zostało miareczkowanie pod kątem doboru odpowiedniego wskaźnika alkacymetrycznego w zależności od rodzaju miareczkowanego roztworu (analitu) oraz roztworu titranta.
Tutorial: pierwiastek stopnia trzeciego z liczby zapisanej w notacji wykładniczej - wykorzystanie kalkulatora prostego
W filmie wyjaśniony został sposób obliczenia pierwiastka stopnia trzeciego z liczby zapisanej w notacji wykładniczej, jeśli dysponujemy kalkulatorem prostym.
UWAGA: wymagana jest znajomość podstawowych działań na potęgach oraz pierwiastkach.
Określanie symbolu pierwiastka chemicznego na podstawie opisu rozmieszczenia jego elektronów. Zadanie 1.1. Arkusz CKE chemia maj 2020 rozszerzony (2 punkty)
O dwóch pierwiastkach umownie oznaczonych literami X i Z wiadomo, że:
● oba przyjmują w związkach chemicznych taki sam maksymalny stopień utlenienia,
● konfiguracja elektronowa atomu pierwiastka X w stanie wzbudzonym, który powstał w wyniku przeniesienia jednego z elektronów sparowanych na podpowłokę wyższą energetycznie i nieobsadzoną, może zostać przedstawiona w postaci zapisu:
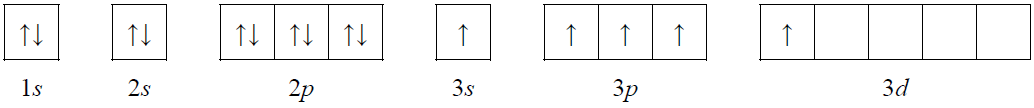
● w stanie podstawowym atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d pięć elektronów.
Wpisz do tabeli symbol pierwiastka X i symbol pierwiastka Z, numer grupy oraz symbol bloku konfiguracyjnego, do których należy każdy z pierwiastków.
Zapis wzoru wodorku oraz wartości maksymalnego stopnia utlenienia pierwiastków. Zadanie 1.2. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
O dwóch pierwiastkach umownie oznaczonych literami X i Z wiadomo, że:
● oba przyjmują w związkach chemicznych taki sam maksymalny stopień utlenienia,
● konfiguracja elektronowa atomu pierwiastka X w stanie wzbudzonym, który powstał w wyniku przeniesienia jednego z elektronów sparowanych na podpowłokę wyższą energetycznie i nieobsadzoną, może zostać przedstawiona w postaci zapisu:
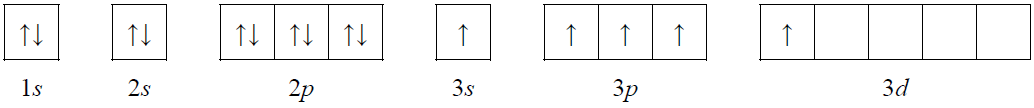
● w stanie podstawowym atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d pięć elektronów.
Napisz wzór sumaryczny wodorku pierwiastka X oraz maksymalny stopień utlenienia, jaki przyjmują pierwiastki X i Z w związkach chemicznych.
Wzór sumaryczny wodorku pierwiastka X:
Maksymalny stopień utlenienia, jaki przyjmują pierwiastki X i Z w związkach chemicznych:
Zapis pełnej konfiguracji elektronowej kationu z użyciem symboli podpowłok. Zadanie 1.3. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
O dwóch pierwiastkach umownie oznaczonych literami X i Z wiadomo, że:
● oba przyjmują w związkach chemicznych taki sam maksymalny stopień utlenienia,
● konfiguracja elektronowa atomu pierwiastka X w stanie wzbudzonym, który powstał w wyniku przeniesienia jednego z elektronów sparowanych na podpowłokę wyższą energetycznie i nieobsadzoną, może zostać przedstawiona w postaci zapisu:
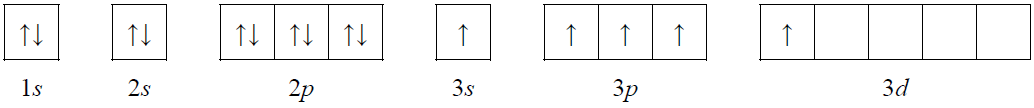
● w stanie podstawowym atom pierwiastka Z ma łącznie na ostatniej powłoce i na podpowłoce 3d pięć elektronów.
Przedstaw pełną konfigurację elektronową jonu Z2+ w stanie podstawowym. Zastosuj zapis z uwzględnieniem podpowłok.
Przypisywanie temperatury wrzenia do substancji. Zadanie 2. Arkusz CKE chemia maj 2020 rozszerzony (1 punkt)
Wpisz do tabeli temperaturę wrzenia wymienionych substancji (H2, CaCl2, HCl) pod ciśnieniem atmosferycznym. Wartości temperatury wrzenia wybierz spośród następujących: –253 oC, –85 oC, 100 oC, 1935 oC.





