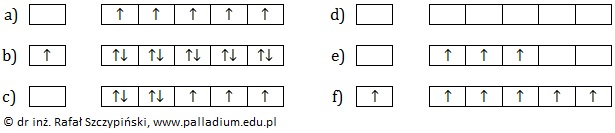
Wybór odpowiedniego pierwiastka oraz określenie sumarycznej wartości pobocznych liczb kwantowych jego elektronów niesparowanych
Podczas wzbudzania elektronu następuje jego przeniesienie na wyższy poziom energetyczny. Rysunki poniżej przedstawiają schematy fragmentów klatkowych konfiguracji elektronowych kilku pierwiastków chemicznych w stanie podstawowym lub wzbudzonym.
Napisz oznaczenie (a÷d) tego pierwiastka chemicznego, który ma największą liczbę elektronów walencyjnych wśród wymienionych pierwiastków, a następnie określ sumaryczną wartość pobocznych liczb kwantowych opisujących jego wszystkie elektrony niesparowane w przedstawionym schemacie klatkowym konfiguracji elektronowej. Pierwiastek: Sumaryczna wartość pobocznych liczb kwantowych: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie najsilniejszego utleniacza oraz najsilniejszego reduktora w zbiorze pierwiastków chemicznych
Pod literami A÷E kryją się symbole pięciu pierwiastków chemicznych. Wiadomo, że pierwiastek A ma trzy powłoki elektronowe i tworzy dwuujemne jony proste. Drobina powstała w wyniku przyłączenia jednego elektronu do pierwiastka B jest izoelektronowa z atomem argonu. W skróconej konfiguracji elektronowej pierwiastka C jest w sumie 16 elektronów opisanych orbitalami s, p i d, a jego masa atomowa jest mniejsza od masy atomowej kryptonu. Pierwiastek D ma największe powinowactwo elektronowe spośród wszystkich znanych nam pierwiastków. Pierwiastek E jest niemetalem, a jego atomy mają o jedną powłokę elektronową więcej niż atomy pierwiastka C i (w stanie podstawowym) parzystą liczbę elektronów niesparowanych.
Który spośród pierwiastków A÷E jest najsilniejszym utleniaczem, a który z nich najsilniejszym reduktorem? Uzasadnij swój wybór. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie symbolu pierwiastka chemicznego oraz konfiguracji elektronowej na podstawie opisu jego elektronów walencyjnych
W stanie podstawowym w atomach pewnego pierwiastka X elektrony walencyjne opisane orbitalami 3d stanowią dokładnie 60% jego wszystkich elektronów walencyjnych.
Podaj symbol pierwiastka X oraz jego pełną konfigurację elektronową. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie symbolu pierwiastka chemicznego na podstawie opisu rozmieszczenia jego elektronów
W atomie pewnego pierwiastka chemicznego X, który w układzie okresowym leży przed pierwiastkiem Y o skróconej konfiguracji elektronowej [Ar] 3d104s24p6, w stanie podstawowym liczba sparowanych elektronów walencyjnych opisanych orbitalem s równa jest liczbie jego walencyjnych elektronów niesparowanych opisanych orbitalami d. Po utworzeniu drobiny X2+, liczba jej elektronów niesparowanych jest trzykrotnie mniejsza od liczby jej elektronów sparowanych tej samej podpowłoki elektronowej.
Opisanym pierwiastkiem X jest (podaj symbol lub nazwę) ……………………………, a liczba elektronów znajdujących się w jonie X2+ każdego z izotopów pierwiastka X wynosi ……. . © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru jonu prostego na podstawie opisu rozmieszczenia jego elektronów
W atomie metalicznego pierwiastka o czterech powłokach elektronowych, w stanie podstawowym liczba walencyjnych elektronów sparowanych jest dziesięciokrotnie większa od liczby elektronów niesparowanych.
Podaj wzór oraz skróconą (względem poprzedzającego gazu szlachetnego) konfigurację elektronową dwudodatniego jonu tego pierwiastka. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie symbolu pierwiastka oraz jego skróconej konfiguracji elektronowej na podstawie opisu rozmieszczenia elektronów
Elektrony pewnego pierwiastka chemicznego X rozmieszczone są na pięciu powłokach elektronowych, przy czym:
– elektrony walencyjne zajmują wyłącznie jedną powłokę,
– sparowane elektrony walencyjne zajmują dwie podpowłoki i jest ich dwukrotnie więcej, niż walencyjnych elektronów niesparowanych.
Podaj symbol lub nazwę opisanego pierwiastka oraz jego skróconą (względem poprzedzającego gazu szlachetnego) konfigurację elektronową. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone