Te zadania pojawiły się na maturze (atom, cząsteczka, układ okresowy)
2025:
Zadanie 1.1, Zadanie 1.2, Zadanie 1.3, Zadanie 2.1, Zadanie 2.2, Zadanie 5.2
2024:
Zadanie 1.1, Zadanie 1.2, Zadanie 1.3, Zadanie 2.1, Zadanie 2.2, Zadanie 3, Zadanie 4, Zadanie 5, Zadanie 1.1, Zadanie 1.2, Zadanie 1.3, Zadanie 2.1, Zadanie 2.2, Zadanie 2.3, Zadanie 3.1, Zadanie 3.2, Zadanie 3.3
2023:
Zadanie 1.1, Zadanie 1.2, Zadanie 1.3, Zadanie 2, Zadanie 3, Zadanie 4
2022:
Zadanie 1.1, Zadanie 1.2, Zadanie 2, Zadanie 3.1, Zadanie 3.2
2021:
Zadanie 1, Zadanie 2, Zadanie 3, Zadanie 12, Zadanie 32
2020:
Zadanie 1.1, Zadanie 1.2, Zadanie 1.3, Zadanie 2, Zadanie 3, Zadanie 4.1, Zadanie 4.2, Zadanie 5
2019:
2018:
Zadanie 1.1, Zadanie 1.2, Zadanie 1.3, Zadanie 2, Zadanie 3, Zadanie 29
2017:
Zadanie 1.1, Zadanie 1.2, Zadanie 1.3, Zadanie 2, Zadanie 3.1, Zadanie 29.2
2016:
Zadanie 1.1, Zadanie 1.2, Zadanie 2, Zadanie 3
2015:
Zadanie 1, Zadanie 2, Zadanie 3, Zadanie 4, Zadanie 5.1, Zadanie 5.2, Zadanie 6, Zadanie 7
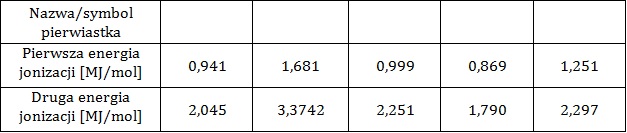
Wyjaśnienie, dlaczego druga energia jonizacji potasu jest większa niż druga energia jonizacji wapnia
Pierwszą energią jonizacji nazywamy taką ilość energii, jaką należy dostarczyć do atomu, aby oderwać od niego jeden elektron. W przypadku odrywania kolejnych elektronów mówimy wówczas kolejno o drugiej, trzeciej oraz n-tej energii jonizacji. W tabeli zebrano dane na temat wartości pierwszej i drugiej energii jonizacji pięciu kolejnych litowców.
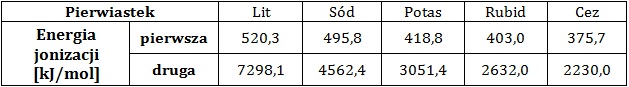
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Druga energia jonizacji potasu ma wartość ponad 2,5-krotnie większą od drugiej energii jonizacji wapnia.
Wyjaśnij, jaka jest tego przyczyna? Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyjaśnienie, dlaczego pierwsza energia jonizacji ma mniejszą wartość od drugiej energii jonizacji
Pierwszą energią jonizacji nazywamy taką ilość energii, jaką należy dostarczyć do atomu, aby oderwać od niego jeden elektron. W przypadku odrywania kolejnych elektronów mówimy wówczas kolejno o drugiej, trzeciej oraz n-tej energii jonizacji. W tabeli zebrano dane na temat wartości pierwszej i drugiej energii jonizacji pięciu kolejnych litowców.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Wyjaśnij, dlaczego pierwsza energia jonizacji ma zawsze mniejszą wartość od wartości drugiej energii jonizacji? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Uzasadnienie zmiany wartości energii jonizacji u kolejnych litowców
Pierwszą energią jonizacji nazywamy taką ilość energii, jaką należy dostarczyć do atomu, aby oderwać od niego jeden elektron. W przypadku odrywania kolejnych elektronów mówimy wówczas kolejno o drugiej, trzeciej oraz n-tej energii jonizacji. W tabeli zebrano dane na temat wartości pierwszej i drugiej energii jonizacji pięciu kolejnych litowców.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Wyjaśnij, dlaczego wartość pierwszej energii jonizacji maleje wraz ze wzrostem masy atomowej litowca? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Dlaczego dla atomu wodoru nie wyznaczono drugiej energii jonizacji
Wyjaśnij, dlaczego dla atomu wodoru nie wyznaczono wartości drugiej energii jonizacji? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie liczb cząstek elementarnych w atomie
Miedź występuje w postaci dwóch izotopów różniących się dwoma neutronami, przy czym lżejszy z nich ma 34 takie cząstki elementarne.
Określ liczbę protonów, neutronów, elektronów oraz nukleonów znajdujących się w jednym atomie cięższego z izotopów miedzi. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór nuklidów spełniających określone warunki dotyczące NMR, liczb powłok elektronowych oraz elektronów walencyjnych
Wirujące wokół osi jądro atomowe wytwarza pole magnetyczne i ma moment pędu zwany spinem jądrowym (spinowym momentem pędu), którego wartość zależy od wartości jądrowej spinowej liczby kwantowej (I). Wartość I ściśle powiązana jest ze składem jądra atomowego nuklidu, co w sposób schematyczny przedstawiono w tabeli:

Właściwości magnetyczne izotopów wykorzystuje się między innymi w spektroskopii NMR, która jest popularną techniką analityczną. Za jej pośrednictwem badana jest na przykład struktura związków chemicznych, przy czym gdy dla danego jądra atomowego wartość I równa jest zero, wówczas nie wykazuje ono czynności w spektroskopii NMR.
Na podstawie: W. Szczepaniak, Metody instrumentalne w analizie chemicznej, Warszawa 2012.
Dany jest zestaw wybranych nuklidów: 2H, 3H, 11B, 12C, 16O, 19F, 28Si, 32S, 35Cl, 127I.
Spośród wymienionych nuklidów wpisz do tabeli te, które spełniają opisane w niej warunki: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone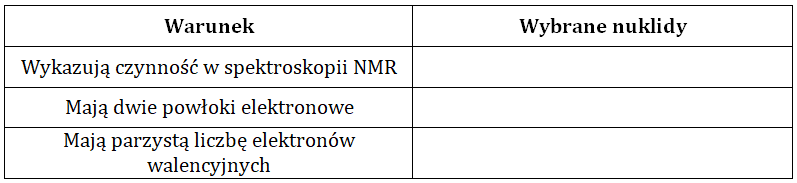
Przypisywanie wartości liczb kwantowych do elektronu
Konfigurację walencyjną atomów nuklidu 219At można przedstawić w postaci 6s²6p⁵.
Podaj wartości liczb kwantowych – głównej (n), pobocznej (l), magnetycznej (m) oraz magnetycznej spinowej (ms), jakie opisują niesparowany elektron w atomie nuklidu 219At. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie składu izotopowego litu (dwa izotopy)
Lit jest pierwiastkiem, który występuje w postaci dwóch izotopów różniących się jednym neutronem. Lżejszy z nich stanowi 7,5% wszystkich atomów tego pierwiastka.
Wykonując stosowne obliczenia ustal liczby masowe obu izotopów litu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie bezwzględnej masy cząsteczki tlenu zbudowanej z dwóch różnych izotopów
Naturalnie występujący w przyrodzie tlen jest mieszaniną trzech izotopów. Najlżejszy z nich w jądrze atomowym ma 8 neutronów i stanowi 99,757% tego pierwiastka chemicznego. Kolejne dwa izotopy różnią się od siebie jednym neutronem, a najcięższy z nich ma 10 takich cząstek elementarnych. Masa atomowa tlenu wynosi 16,0045 u.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Oblicz bezwzględną masę cząsteczki tlenu złożonej z dwóch najlżejszych jego izotopów. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone