Ocena, jak zmieni się wartość stopnia dysocjacji słabego kwasu po dodaniu roztworu mocnego kwasu. Zadanie 12.1. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
W temperaturze T rozpuszczono w wodzie kwas HX. Równowagę w otrzymanym roztworze ilustruje równanie
HX + H2O ⇄ H3O+ + X–
Poniższy wykres przedstawia procentowy udział drobin znajdujących się w wodnym roztworze kwasu HX o temperaturze T (na wykresie nie uwzględniono wody oraz jonów pochodzących z autodysocjacji wody).

Do wodnego roztworu kwasu HX dodano niewielką ilość wodnego roztworu mocnego kwasu. Temperatura roztworu nie uległa zmianie.
Oceń, czy zmieni się (wzrośnie, zmaleje) czy nie ulegnie zmianie wartość stopnia dysocjacji kwasu HX, jeśli do jego wodnego roztworu doda się niewielką ilość mocnego kwasu. Odpowiedź uzasadnij. Ocena: Uzasadnienie:
Ocena, jak zmieni się wartość stałej dysocjacji słabego kwasu po dodaniu roztworu mocnego kwasu. Zadanie 12.2. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
W temperaturze T rozpuszczono w wodzie kwas HX. Równowagę w otrzymanym roztworze ilustruje równanie
HX + H2O ⇄ H3O+ + X–
Poniższy wykres przedstawia procentowy udział drobin znajdujących się w wodnym roztworze kwasu HX o temperaturze T (na wykresie nie uwzględniono wody oraz jonów pochodzących z autodysocjacji wody).

Do wodnego roztworu kwasu HX dodano niewielką ilość wodnego roztworu mocnego kwasu. Temperatura roztworu nie uległa zmianie.
Oceń, czy zmieni się (wzrośnie, zmaleje) czy nie ulegnie zmianie wartość stałej dysocjacji kwasu HX, jeśli do jego wodnego roztworu doda się niewielką ilość mocnego kwasu. Odpowiedź uzasadnij. Ocena: Uzasadnienie:
Obliczanie objętości roztworu kwasu jaką należy wprowadzić do roztworu zasady, aby uzyskać określone pH roztworu. Zadanie 13. Arkusz CKE chemia maj 2019 rozszerzony (2 punkty)
Reakcja kwasu solnego z wodorotlenkiem potasu przebiega zgodnie z równaniem
HCl + KOH → KCl + H2O
Oblicz objętość kwasu solnego o stężeniu 0,1 mol·dm–3, jaką należy dodać do 300 cm3 wodnego roztworu wodorotlenku potasu o stężeniu 0,2 mol·dm–3, aby otrzymany roztwór miał pH = 13. W obliczeniach przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworów.
Określenie efektu cieplnego procesu autodysocjacji wody oraz jak zmienia się pH wody ze wzrostem temperatury. Zadanie 14. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
W czystej wodzie ustala się stan równowagi reakcji autoprotolizy, która zachodzi zgodnie z równaniem:
2H2O ⇄ H3O+ + OH–
Tę reakcję opisuje stała równowagi nazywana iloczynem jonowym wody. Wyraża się ona równaniem:
Kw = [H3O+]·[ OH–]
Poniżej przedstawiono wartości iloczynu jonowego wody Kw w zakresie temperatury 0 ºC–100 ºC (pod ciśnieniem atmosferycznym).

Uzupełnij poniższe zdania. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie. Reakcja autodysocjacji wody jest (egzoenergetyczna / endoenergetyczna). Wraz ze wzrostem temperatury pH czystej wody (maleje / rośnie / nie ulega zmianie).
Zapis równań reakcji autoprotolizy ciekłego amoniaku, metanolu i kwasu mrówkowego. Zadanie 15.1. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
W czystej wodzie ustala się stan równowagi reakcji autoprotolizy, która zachodzi zgodnie z równaniem:
2H2O ⇄ H3O+ + OH–
Tę reakcję opisuje stała równowagi nazywana iloczynem jonowym wody. Wyraża się ona równaniem:
Kw = [H3O+]·[ OH–]
Zdolność autoprotolizy charakteryzuje nie tylko wodę, lecz także inne rozpuszczalniki, np.: ciekły amoniak (skroplony pod zwiększonym ciśnieniem), metanol i kwas mrówkowy.
Napisz trzy równania reakcji autoprotolizy: ciekłego amoniaku, metanolu i kwasu mrówkowego. Zastosuj wzory półstrukturalne (grupowe) organicznych produktów reakcji. 2NH3 ⇄ 2CH3OH ⇄ 2HCOOH ⇄
Wyjaśnienie przyczyny zdolności cząsteczek amoniaku, metanolu i kwasu mrówkowego do autoprotolizy. Zadanie 15.2. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
W czystej wodzie ustala się stan równowagi reakcji autoprotolizy, która zachodzi zgodnie z równaniem:
2H2O ⇄ H3O+ + OH–
Tę reakcję opisuje stała równowagi nazywana iloczynem jonowym wody. Wyraża się ona równaniem:
Kw = [H3O+]·[ OH–]
Zdolność autoprotolizy charakteryzuje nie tylko wodę, lecz także inne rozpuszczalniki, np.: ciekły amoniak (skroplony pod zwiększonym ciśnieniem), metanol i kwas mrówkowy.
Wyjaśnij, dlaczego cząsteczki amoniaku, metanolu i kwasu mrówkowego mają zdolność odszczepiania i przyłączania protonu w procesie autoprotolizy. Odnieś się do budowy tych cząsteczek. Cząsteczki wymienionych związków mają zdolność odszczepiania protonu, ponieważ: Cząsteczki wymienionych związków mają zdolność przyłączania protonu, ponieważ:
Wybór poprawnych określeń dotyczących wartości stałej dysocjacji kwasu mrówkowego. Zadanie 16. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Zdolność elektrolitu do dysocjacji zależy od właściwości tego elektrolitu oraz od właściwości użytego rozpuszczalnika. Im silniejszą zasadą Brønsteda jest rozpuszczalnik, tym w większym stopniu dysocjuje w nim elektrolit będący kwasem Brønsteda.
Zbadano dysocjację jednoprotonowego kwasu HA w różnych rozpuszczalnikach. W wodzie HA jest słabym kwasem.
Uzupełnij poniższe zdanie. Wybierz i zaznacz nazwę rozpuszczalnika. W danej temperaturze wartość stałej dysocjacji kwasu HA jest największa w roztworze, w którym rozpuszczalnikiem jest (ciekły amoniak / kwas mrówkowy / metanol / woda).
Obliczanie procentowego składu wagowego mieszaniny chlorku sodu i chlorku wapnia. Zadanie 17. Arkusz CKE chemia maj 2019 rozszerzony (2 punkty)
Gazowy chlorowodór można otrzymać w wyniku działania stężonego kwasu siarkowego(VI) na stałe chlorki, np. w reakcjach opisanych równaniami:
2NaCl + H2SO4 → Na2SO4 + 2HCl
CaCl2 + H2SO4 → CaSO4 + 2HCl
Sporządzono 150 g mieszaniny zawierającej tylko NaCl i CaCl2, na którą podziałano stężonym kwasem siarkowym(VI) użytym w nadmiarze. W wyniku tego procesu otrzymano 58,24 dm3 chlorowodoru (w warunkach normalnych).
Oblicz skład wyjściowej mieszaniny w procentach masowych. Przyjmij, że obie reakcje przebiegły z wydajnością równą 100%.
Wybór odpowiedniego odczynnika, którego wprowadzenie do roztworów wywoła określone efekty. Zadanie 18.1. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, w którym badano działanie pewnego odczynnika na dwa wodne roztwory soli. W probówce I znajdował się roztwór siarczanu(IV) sodu, a w probówce II – roztwór krzemianu(IV) sodu. Po dodaniu odczynnika zaobserwowano, że:
• w każdej probówce zaszła reakcja chemiczna;
• przebieg doświadczenia był różny dla obu probówek;
• tylko w jednej z probówek wytrącił się osad.
Uzupełnij schemat doświadczenia. Wybierz i zaznacz w podanym zestawie wzór jednego odczynnika, którego zastosowanie spowodowało efekty opisane w informacji.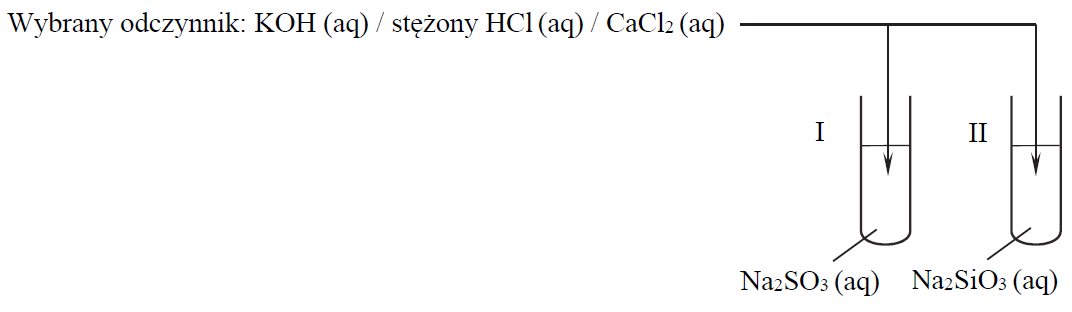
Zapis obserwacji w probówce, w której nie wytrącił się osad. Zadanie 18.2. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, w którym badano działanie pewnego odczynnika na dwa wodne roztwory soli. W probówce I znajdował się roztwór siarczanu(IV) sodu, a w probówce II – roztwór krzemianu(IV) sodu. Po dodaniu odczynnika zaobserwowano, że:
• w każdej probówce zaszła reakcja chemiczna;
• przebieg doświadczenia był różny dla obu probówek;
• tylko w jednej z probówek wytrącił się osad.
Odczynnik wybrano spośród:
KOH (aq), stężony HCl (aq), CaCl2 (aq)
Napisz, co zaobserwowano w probówce, w której nie wytrącił się osad podczas opisanego doświadczenia.
Zapis w formie jonowej skróconej równań dwóch reakcji chemicznych. Zadanie 18.3. Arkusz CKE chemia maj 2019 rozszerzony (2 punkty)
Przeprowadzono doświadczenie, w którym badano działanie pewnego odczynnika na dwa wodne roztwory soli. W probówce I znajdował się roztwór siarczanu(IV) sodu, a w probówce II – roztwór krzemianu(IV) sodu. Po dodaniu odczynnika zaobserwowano, że:
• w każdej probówce zaszła reakcja chemiczna;
• przebieg doświadczenia był różny dla obu probówek;
• tylko w jednej z probówek wytrącił się osad.
Odczynnik wybrano spośród:
KOH (aq), stężony HCl (aq), CaCl2 (aq)
Napisz w formie jonowej skróconej równania reakcji, które przebiegły w probówkach I i II i były przyczyną obserwowanych zmian. Równanie reakcji przebiegającej w probówce I: Równanie reakcji przebiegającej w probówce II:
Ocena poprawności zdań dotyczących kinetyki reakcji cynku z kwasem solnym oraz octowym. Zadanie 19. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Przeprowadzono doświadczenie, w którym do probówki I wlano kwas solny o pH = 2, a do probówki II – wodny roztwór kwasu octowego (etanowego) o pH = 2. Roztwory miały temperaturę 298 K. Następnie do obu probówek dodano po 1 gramie pyłu cynkowego. Opisane doświadczenie zilustrowano poniższym schematem.

Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. W warunkach doświadczenia stężenie molowe kwasu solnego jest większe niż stężenie molowe wodnego roztworu kwasu octowego. 2. Użycie w doświadczeniu wodnych roztworów o pH = 3 skutkowałoby wzrostem szybkości reakcji wyłącznie w probówce II, ponieważ kwas uczestniczący w tej przemianie jest kwasem słabym. 3. Ochłodzenie obu użytych w doświadczeniu wodnych roztworów skutkowałoby zmniejszeniem szybkości wydzielania gazu w przemianach zachodzących w probówkach I i II.
Określenie barwy papierka wskaźnikowego po zakończeniu doświadczenia. Zadanie 20. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Do wodnego roztworu zawierającego 0,1 mola wodorotlenku sodu dodano wodny roztwór zawierający 0,1 mola kwasu etanowego (octowego). Następnie w mieszaninie poreakcyjnej zanurzono żółty uniwersalny papierek wskaźnikowy.
Dokończ poniższe zdanie. Wybierz i zaznacz odpowiedź A, B albo C i jej uzasadnienie 1., 2., 3. albo 4. Uniwersalny papierek wskaźnikowy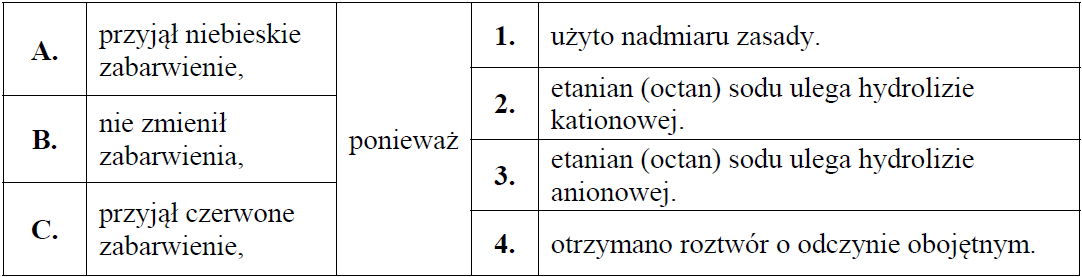
Bilans jonowo-elektronowy reakcji anionów jodanowych(V) z wodorosiarczanowymi(IV). Zadanie 21. Arkusz CKE chemia maj 2019 rozszerzony (2 punkty)
Jod otrzymuje się z saletry chilijskiej, zawierającej głównie azotan(V) sodu, lecz także m.in. śladowe ilości jodanu(V) sodu i jodanu(VII) sodu. Po zatężeniu wodnego roztworu jodany redukuje się do jodu za pomocą wodorosiarczanu(IV) sodu.
Na podstawie: J.D. Lee, Zwięzła chemia nieorganiczna, Warszawa, 1994.
Jedną z opisanych reakcji przedstawia poniższy schemat.
IO3– + HSO3– → I2 + SO42– + H+ + H2O
Napisz w formie jonowej skróconej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równania procesów redukcji i utleniania zachodzących podczas opisanej przemiany. Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie. Równanie procesu redukcji: Równanie procesu utleniania: Schemat reakcji do uzupełnienia: IO3– + HSO3– → I2 + SO42– + H+ + H2O
Zapis równania reakcji otrzymywania 3-bromo-3-metyloheksanu. Zadanie 22. Arkusz CKE chemia maj 2019 rozszerzony (1 punkt)
Jedną z metod otrzymywania halogenoalkanów jest reakcja alkoholu alifatycznego z halogenkiem fosforu(III). Ta reakcja przebiega zgodnie z poniższym schematem, w którym R oznacza grupę alkilową, a X – atom halogenu.
3R–OH + PX3 → 3R–X + H3PO3
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007.
Napisz równanie reakcji otrzymywania 3-bromo-3-metyloheksanu opisaną metodą – zastosuj wzory półstrukturalne (grupowe) reagentów organicznych. Napisz nazwę systematyczną użytego alkoholu. Równanie reakcji: Nazwa systematyczna alkoholu:

