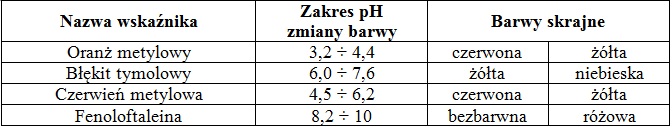
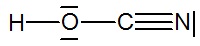Ważnym produktem przemysłu azotowego jest melamina – substancja, która w temperaturze 25 oC pod ciśnieniem normalnym ma stały stan skupienia, a jej rozkład przebiega w temperaturze około 600 oC.
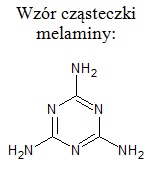
Substratem wejściowym używanym do produkcji melaminy jest mocznik, a proces prowadzi się w temperaturze 400 K, pod ciśnieniem 8 MPa. W warunkach tych produktem pośrednim procesu jest kwas izocyjanowy (HNCO), który praktycznie natychmiast ulega kondensacji do melaminy z wydzieleniem dwutlenku węgla. Opisane przemiany ilustrują następujące równania chemiczne:
6CO(NH2)2 ⟶ 6HNCO + 6NH3 ΔHo = 984 kJ
6HNCO ⟶ C3N3(NH2)3 + 3CO2 ΔHo = –355 kJ
Na podstawie: E. Grzywa, J. Molenda, Technologia podstawowych syntez organicznych. Tom 2, Warszawa 2008 oraz K. Schmidt-Szałowski, M. Szafran, E. Bobryk, J. Sentek, Technologia chemiczna. Przemysł nieorganiczny, Warszawa 2013.
Podkreśl wyrażenia w nawiasach tak, aby powstały zdania prawdziwe.
Podczas rozkładu 3 kg mocznika (z układu wydziela się / do układu dostarczana jest) energia na sposób ciepła równa (164 kJ / 8,2 MJ). Powstały wówczas kwas izocyjanowy rozkłada się z 98% wydajnością, czemu towarzyszy (pobór z otoczenia / wydzielenie do otoczenia) energii cieplnej o wartości około (58 kJ / 2,9 MJ). Na podstawie wartości entalpii opisanych przemian można stwierdzić, że pierwsza z nich jest procesem (egzotermicznym / endotermicznym), natomiast druga to proces (egzotermiczny / endotermiczny).
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone