Określenie efektu energetycznego reakcji chemicznej. Zadanie 5. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
CO2 (g) + C (s) ⇄ 2CO (g)
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.
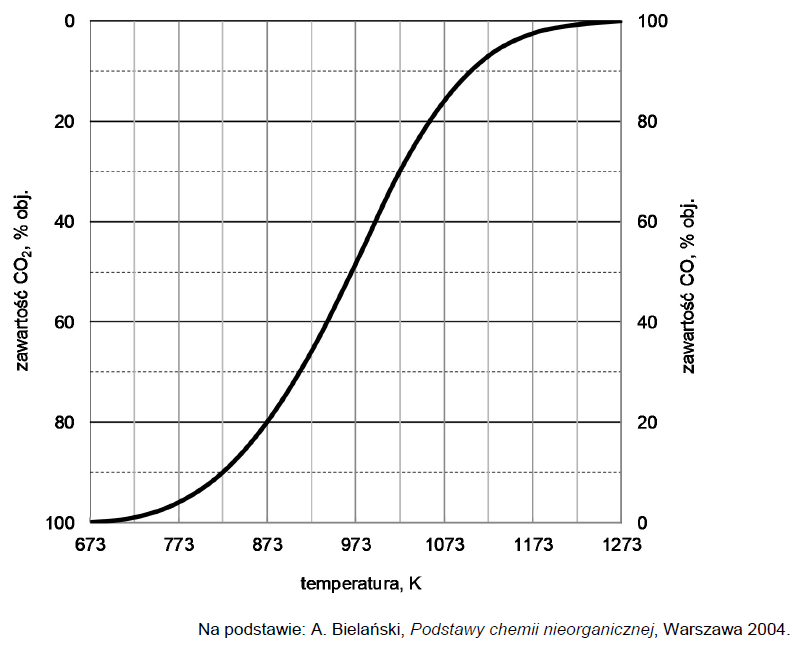
Rozstrzygnij, czy reakcja pomiędzy tlenkiem węgla(IV) i węglem jest procesem egzoenergetycznym. Uzasadnij swoją odpowiedź. Rozstrzygnięcie: Uzasadnienie:
Obliczanie wartości stałej stężeniowej reakcji chemicznej. Zadanie 6. Arkusz CKE chemia maj 2021 rozszerzony (2 punkty)
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
CO2 (g) + C (s) ⇄ 2CO (g)
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.

W mieszaninie gazów doskonałych sumaryczne stężenie molowe wyraża się wzorem:
![]()
gdzie:
𝑝 – ciśnienie w hPa
𝑇 – temperatura w K
𝑅 – stała gazowa równa 83,1 hPa∙dm3∙K–1∙mol–1.
Ponadto

Oblicz wartość stężeniowej stałej równowagi opisanej przemiany w temperaturze 873 K i pod ciśnieniem 1013 hPa. Wyrażenie na stężeniową stałą równowagi tej reakcji przyjmuje postać: Załóż, że CO i CO2 są gazami doskonałymi.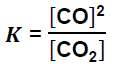
Zapis równań reakcji chemicznych z udziałem sodu, litu, tlenu i azotu. Zadanie 8. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Litowce są metalami miękkimi, a berylowce są od nich nieco twardsze. Ich twardość maleje w grupie wraz ze wzrostem liczby atomowej pierwiastka. Gęstość litu, sodu i potasu jest mniejsza od gęstości wody, a gęstość rubidu i cezu oraz wszystkich berylowców – większa. Lit spala się w tlenie do tlenku. Z azotem w temperaturze pokojowej łączy się powoli, a produktem tej reakcji jest azotek litu Li3N. Z kolei sód spala się w tlenie do nadtlenku sodu, związku o wzorze Na2O2, w którym tlen występuje na –I stopniu utlenienia. Magnez, spalany w powietrzu, reaguje nie tylko z tlenem, lecz także z azotem i tlenkiem węgla(IV).
Na podstawie: K. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007 oraz L. Jones, P. Atkins, Chemia ogólna, Warszawa 2006.
Napisz w formie cząsteczkowej równania opisanych w informacji przemian. Spalanie sodu w tlenie: Reakcja litu z azotem:
Określenie czy w wyniku przeprowadzenia różnych doświadczeń chemicznych uzyskano czysty tlenek magnezu. Zadanie 9.1. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Litowce są metalami miękkimi, a berylowce są od nich nieco twardsze. Ich twardość maleje w grupie wraz ze wzrostem liczby atomowej pierwiastka. Gęstość litu, sodu i potasu jest mniejsza od gęstości wody, a gęstość rubidu i cezu oraz wszystkich berylowców – większa. Lit spala się w tlenie do tlenku. Z azotem w temperaturze pokojowej łączy się powoli, a produktem tej reakcji jest azotek litu Li3N. Z kolei sód spala się w tlenie do nadtlenku sodu, związku o wzorze Na2O2, w którym tlen występuje na –I stopniu utlenienia. Magnez, spalany w powietrzu, reaguje nie tylko z tlenem, lecz także z azotem i tlenkiem węgla(IV).
Na podstawie: K. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007 oraz L. Jones, P. Atkins, Chemia ogólna, Warszawa 2006.
W celu otrzymania tlenku magnezu przeprowadzono dwa doświadczenia: I i II. W doświadczeniu I tlenek magnezu otrzymano przez całkowity rozkład MgCO3. W doświadczeniu II tlenek magnezu otrzymano przez spalenie magnezu w powietrzu.
Rozstrzygnij, czy w obu doświadczeniach otrzymano czysty tlenek magnezu. Uzasadnij odpowiedź. Rozstrzygnięcie: Uzasadnienie:
Wyjaśnienie, dlaczego palący się magnez nie jest gaszony wodą. Zadanie 9.2. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Litowce są metalami miękkimi, a berylowce są od nich nieco twardsze. Ich twardość maleje w grupie wraz ze wzrostem liczby atomowej pierwiastka. Gęstość litu, sodu i potasu jest mniejsza od gęstości wody, a gęstość rubidu i cezu oraz wszystkich berylowców – większa. Lit spala się w tlenie do tlenku. Z azotem w temperaturze pokojowej łączy się powoli, a produktem tej reakcji jest azotek litu Li3N. Z kolei sód spala się w tlenie do nadtlenku sodu, związku o wzorze Na2O2, w którym tlen występuje na –I stopniu utlenienia. Magnez, spalany w powietrzu, reaguje nie tylko z tlenem, lecz także z azotem i tlenkiem węgla(IV).
Na podstawie: K. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007 oraz L. Jones, P. Atkins, Chemia ogólna, Warszawa 2006.
W celu otrzymania tlenku magnezu przeprowadzono dwa doświadczenia: I i II. W doświadczeniu I tlenek magnezu otrzymano przez całkowity rozkład MgCO3. W doświadczeniu II tlenek magnezu otrzymano przez spalenie magnezu w powietrzu.
Wyjaśnij, dlaczego palącego się magnezu, czyli tzw. pożarów magnezowych, nie wolno gasić wodą.
Rysowanie wykresu zależności masy węglanu magnezu od czasu jego rozkładu. Zadanie 10.1. Arkusz CKE chemia maj 2021 rozszerzony (2 punkty)
Odważkę czystego węglanu magnezu o masie 8,4 g ogrzewano w piecu nagrzanym do temperatury T, w której ta sól ulega rozkładowi termicznemu – zgodnie z równaniem:
![]()
W czasie ogrzewania węglanu magnezu mierzono w dziesięciominutowych odstępach sumaryczną ilość powstałego gazowego produktu termicznego rozkładu tej soli. Następnie obliczono masę nierozłożonego węglanu magnezu w każdym momencie pomiaru.
Oblicz i wpisz do tabeli brakujące wartości masy (w gramach) nierozłożonego węglanu magnezu zaokrąglone do pierwszego miejsca po przecinku. Następnie narysuj wykres przedstawiający zależność masy węglanu magnezu od czasu prowadzenia jego termicznego rozkładu.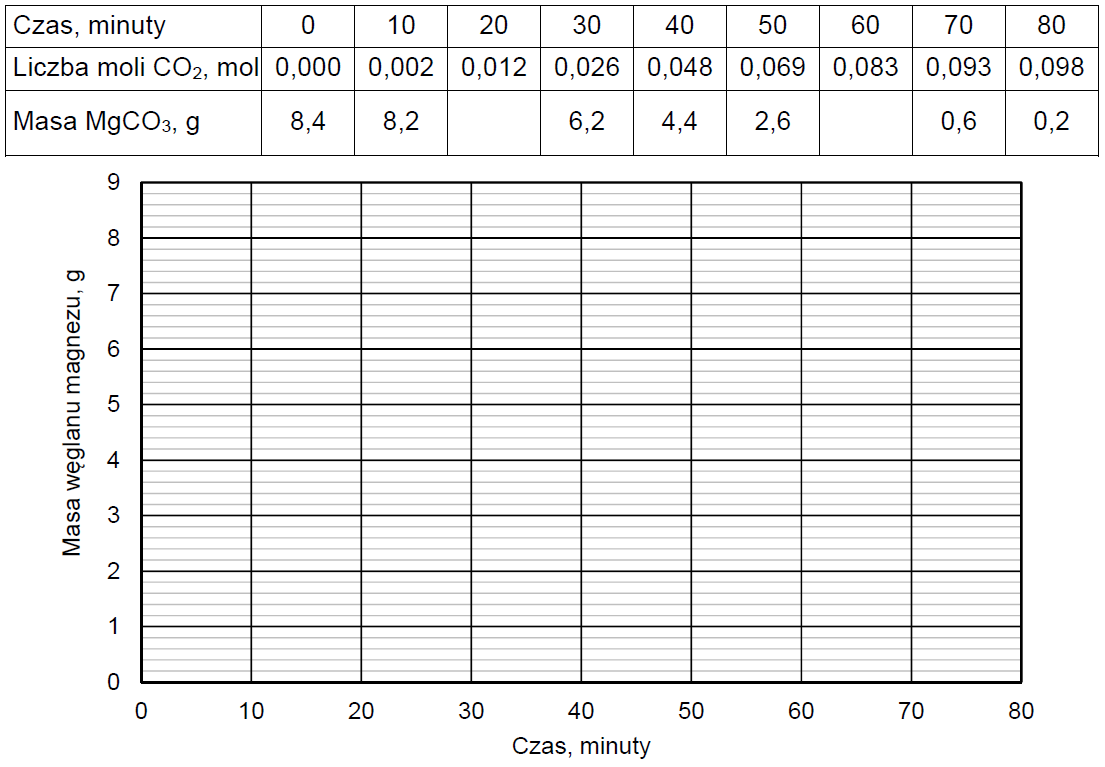
Ocena poprawności zdań dotyczących rozkładu węglanu magnezu w czasie. Zadanie 10.2. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Odważkę czystego węglanu magnezu o masie 8,4 g ogrzewano w piecu nagrzanym do temperatury T, w której ta sól ulega rozkładowi termicznemu – zgodnie z równaniem:
![]()
W czasie ogrzewania węglanu magnezu mierzono w dziesięciominutowych odstępach sumaryczną ilość powstałego gazowego produktu termicznego rozkładu tej soli. Następnie obliczono masę nierozłożonego węglanu magnezu w każdym momencie pomiaru.
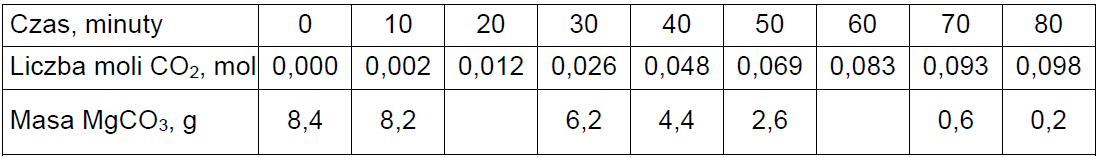
Oceń prawdziwość poniższych zdań. Zaznacz P, jeżeli zdanie jest prawdziwe, albo F – jeśli jest fałszywe. 1. W ciągu pierwszych 40 minut doświadczenia mniej niż połowa użytego węglanu magnezu uległo termicznemu rozkładowi. 2. W ciągu pierwszych 70 minut doświadczenia powstało około 3,7 g tlenku magnezu. 3. Po upływie 80 minut masa stałej mieszaniny substratu i produktu reakcji była mniejsza o 8,2 g od masy użytej odważki czystego węglanu magnezu.
Wybór związków chemicznych do przeprowadzenia reakcji chemicznych według schematu. Zadanie 11.1. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Przeprowadzono ciąg przemian chemicznych przedstawiony na poniższym schemacie.
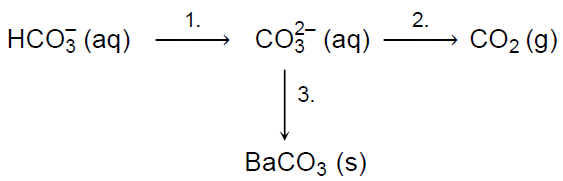
Spośród wymienionych odczynników ● wodorotlenek potasu ● kwas etanowy ● siarczan(VI) baru ● azotan(V) baru wybierz i wpisz do tabeli nazwy lub wzory tych substancji, które mogły być użyte w poszczególnych etapach opisanego schematem ciągu przemian.
Zapis równań reakcji chemicznych oznaczonych na schemacie. Zadanie 11.2. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Przeprowadzono ciąg przemian chemicznych przedstawiony na poniższym schemacie.
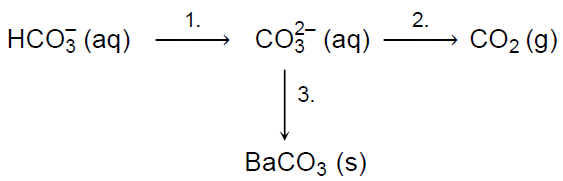
Napisz w formie jonowej skróconej równania reakcji oznaczonych na schemacie numerami 1. i 2. Równanie reakcji 1.: Równanie reakcji 2.:
Rysowanie wzoru elektronowego cząsteczki izomeru cyjanowodoru. Zadanie 12. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Cyjanowodór jest lotną cieczą. Występuje w postaci dwóch izomerycznych odmian, które pozostają ze sobą w równowadze:
HCN ⇄ HNC
cyjanowodór ⇄ izocyjanowodór
W temperaturze pokojowej na 99 cząsteczek HCN przypada jedna cząsteczka HNC.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Napisz wzór elektronowy cząsteczki tej izomerycznej odmiany cyjanowodoru, która w temperaturze pokojowej stanowi formę dominującą. Zaznacz kreskami pary elektronowe wiązań chemicznych oraz wolne pary elektronowe. Określ hybrydyzację orbitali walencyjnych atomu węgla w tej cząsteczce. Wzór elektronowy: Hybrydyzacja orbitali walencyjnych atomu węgla:
Obliczanie liczby cząsteczek izocyjanowodoru w masie mieszaniny. Zadanie 13. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Cyjanowodór jest lotną cieczą. Występuje w postaci dwóch izomerycznych odmian, które pozostają ze sobą w równowadze:
HCN ⇄ HNC
cyjanowodór ⇄ izocyjanowodór
W temperaturze pokojowej na 99 cząsteczek HCN przypada jedna cząsteczka HNC.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Oblicz, ile cząsteczek izocyjanowodoru znajduje się w temperaturze pokojowej w próbce mieszaniny cyjanowodoru i izocyjanowodoru o masie 1,35 g zawierającej obie odmiany w stanie równowagi.
Określenie, czy cyjanowodór spowoduje wypieranie dwutlenku węgla z wodorowęglanu sodu. Zadanie 14. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Cyjanowodór jest lotną cieczą. Występuje w postaci dwóch izomerycznych odmian, które pozostają ze sobą w równowadze:
HCN ⇄ HNC
cyjanowodór ⇄ izocyjanowodór
W temperaturze pokojowej na 99 cząsteczek HCN przypada jedna cząsteczka HNC.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Cyjanowodór bardzo dobrze rozpuszcza się w wodzie i w niewielkim stopniu ulega dysocjacji
jonowej zgodnie z równaniem:
HCN + H2O ⇄ H3O+ + CN–
Wodny roztwór cyjanowodoru nosi nazwę kwasu cyjanowodorowego. W temperaturze 25 °C
stała dysocjacji tego kwasu 𝐾a = 6,2 ∙10–10.
Na podstawie: CRC Handbook of Chemistry and Physics 97th Edition, CRC Press 2017.
Do probówki zawierającej wodny roztwór wodorowęglanu sodu NaHCO3 wprowadzono – pod wyciągiem – kwas cyjanowodorowy. Przebieg doświadczenia przedstawiono na rysunku.
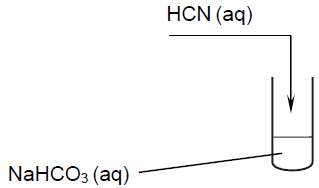
Rozstrzygnij, czy po wprowadzeniu kwasu cyjanowodorowego do probówki z wodnym roztworem wodorowęglanu sodu zaobserwowano pienienie się zawartości probówki. Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Określenie, ile razy zmalało stężenie jonów hydroniowych. Zadanie 15. Arkusz CKE chemia maj 2021 rozszerzony (2 punkty)
Do 20 cm3 wodnego roztworu HCl o pH = 1,0 dodano 30 cm3 wodnego roztworu NaOH o stężeniu 0,060 mol∙dm−3. Po zmieszaniu roztworów przebiegła reakcja chemiczna opisana równaniem:
H3O+ + OH– → 2H2O
Wykonaj odpowiednie obliczenia i napisz, ile razy zmalało stężenie jonów hydroniowych H3O+ po dodaniu roztworu NaOH. Przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworów.
Uszeregowanie wartości stałych równowag kwasu arsenowego(V) zgodnie z rosnącą wartością oraz równania dysocjacji w jednym z etapów. Zadanie 16. Arkusz CKE chemia maj 2021 rozszerzony (2 punkty)
Kwas arsenowy(V) H3AsO4 jest kwasem trójprotonowym o mocy zbliżonej do kwasu ortofosforowego(V). Równowagom, które ustalają się w roztworze wodnym tego kwasu, odpowiadają stałe opisane poniższymi wyrażeniami (podanymi w przypadkowej kolejności), w których została pominięta woda będąca środowiskiem reakcji.
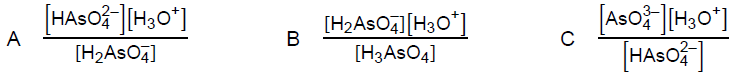
Uszereguj stałe równowagi (wpisz litery A, B oraz C) zgodnie z ich rosnącą wartością. Napisz równanie przemiany, której odpowiada stała równowagi opisana wyrażeniem A. Spośród jonów powstających podczas protolizy (dysocjacji) kwasu arsenowego(V) wybierz i napisz wzór tego, który może pełnić wyłącznie funkcję kwasu Brønsteda. Uszeregowanie: Równanie reakcji: Jon, który może pełnić wyłącznie funkcję kwasu Brønsteda:

