Określenie typu hybrydyzacji oraz stopnia utlenienia wskazanych atomów węgla w cząsteczce mentolu i tymolu. Zadanie 27. Arkusz CKE chemia maj 2021 rozszerzony (2 punkty)
Poniżej przedstawiono wzory dwóch związków organicznych: mentolu i tymolu.
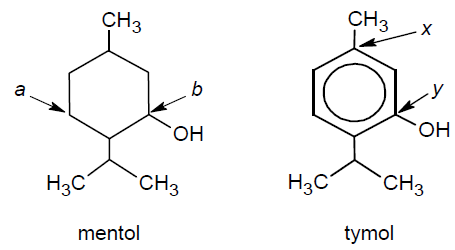
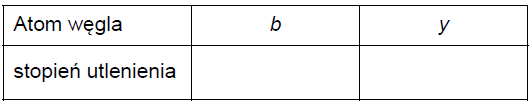
Uzupełnij poniższe tabele. • Określ formalne stopnie utlenienia: atomu węgla oznaczonego we wzorze mentolu literą b oraz atomu węgla oznaczonego we wzorze tymolu literą y.
• Określ hybrydyzację orbitali walencyjnych: atomu węgla oznaczonego we wzorze mentolu literą a oraz atomu węgla oznaczonego we wzorze tymolu literą x.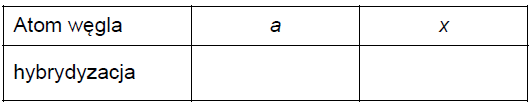
Określenie, czy cząsteczka tymolu jest chiralna wraz z uzasadnieniem. Zadanie 28. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Poniżej przedstawiono wzory dwóch związków organicznych: mentolu i tymolu.

Rozstrzygnij, czy cząsteczka tymolu jest chiralna. Odpowiedź uzasadnij. Rozstrzygnięcie: Uzasadnienie:
Wybór poprawnego fragmentu zdania dotyczącego wartości stałej i stopnia dysocjacji roztworu kwasu mrówkowego po jego rozcieńczeniu. Zadanie 29. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Do 500 cm3 wodnego roztworu kwasu metanowego (mrówkowego) o stężeniu 1 mol ∙ dm−3 dodano 500 cm3 wody. Temperatura otrzymanego roztworu nie uległa zmianie.
Dokończ zdanie. Zaznacz odpowiedź wybraną spośród A–C oraz odpowiedź wybraną spośród 1.–3. Należy wnioskować, że po dodaniu wody do wodnego roztworu kwasu metanowego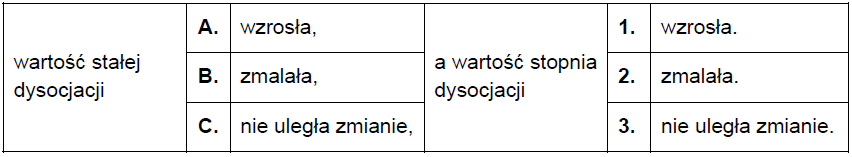
Obliczanie masy kwasu etanowego użytego do równowagowej reakcji estryfikacji. Zadanie 30. Arkusz CKE chemia maj 2021 rozszerzony (2 punkty)
Reakcja estryfikacji, w której uczestniczą kwas etanowy i butan-2-ol, zachodzi w środowisku kwasowym zgodnie z równaniem:
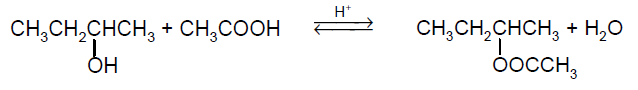
W temperaturze T stężeniowa stała równowagi tej reakcji Kc = 2,12.
Na podstawie: Estryfikacja, https://tsl.wum.edu.pl [dostęp 09.01.2020]
Oblicz, ile gramów bezwodnego kwasu etanowego należy użyć do reakcji z jednym molem butan-2-olu w temperaturze T, aby przereagowało 85% początkowej ilości butan-2-olu.
Wybór poprawnych określeń dotyczących reakcji estryfikacji. Zadanie 31. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Reakcja estryfikacji, w której uczestniczą kwas etanowy i butan-2-ol, zachodzi w środowisku kwasowym zgodnie z równaniem:

W temperaturze T stężeniowa stała równowagi tej reakcji Kc = 2,12.
Na podstawie: Estryfikacja, https://tsl.wum.edu.pl [dostęp 09.01.2020]
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie. Przy użyciu w opisanej reakcji równomolowej mieszaniny kwasu i alkoholu wydajność tej reakcji jest w temperaturze T (niższa niż / równa / wyższa od) 85%. Opisaną reakcję przeprowadza się w środowisku kwasowym, ponieważ jony H+ (katalizują tę reakcję / zwiększają wydajność tej reakcji). W środowisku zasadowym opisany ester ulega hydrolizie, której produktami są butan-2-ol i (kwas etanowy / sól kwasu etanowego).
Wybór poprawnych określeń dotyczących wiązań wodorowych tworzonych przez kwas octowy. Zadanie 32. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
Cząsteczki kwasu etanowego mogą tworzyć dimer:
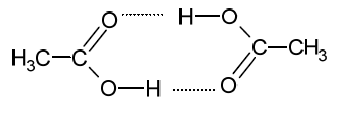
Dimer ten występuje w stanie gazowym oraz w roztworach kwasu etanowego w rozpuszczalnikach nietworzących z nim wiązań wodorowych.
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie. Przedstawiony w informacji dimer powstaje w wyniku tworzenia się wiązań (kowalencyjnych / jonowych / wodorowych) między cząsteczkami kwasu etanowego. Rozcieńczony roztwór kwasu etanowego w wodzie (nie zawiera dimerów / zawiera dimery), ponieważ woda (nie tworzy wiązań wodorowych / tworzy wiązania wodorowe) z cząsteczkami kwasu etanowego.
Określenie nazw związków chemicznych jakie zidentyfikowano podczas doświadczenia chemicznego. Zadanie 33.1. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
W dwóch probówkach (I, II) znajdowały się wodne roztwory dwóch substancji wybranych spośród następujących:
glicyna chlorek fenyloamoniowy (C6H5NH3Cl) fenolan sodu
W celu ich identyfikacji przeprowadzono opisane poniżej doświadczenia.
1. Do próbek pobranych z probówek I i II dodano kwas solny, ale w żadnym naczyniu nie zaobserwowano zmian.
2. Z probówek I i II pobrano próbki i wprowadzono do nich wodny roztwór oranżu metylowego. Otrzymano roztwory o różnych barwach. W naczyniu z próbką pobraną z probówki I roztwór przyjął barwę czerwoną.
Podaj nazwy lub wzory związków, które zidentyfikowano podczas przeprowadzonych doświadczeń. Probówka I: Probówka II:
Zapis równania reakcji chemicznej decydującej o odczynie wodnego roztworu. Zadanie 33.2. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
W dwóch probówkach (I, II) znajdowały się wodne roztwory dwóch substancji wybranych spośród następujących:
glicyna chlorek fenyloamoniowy (C6H5NH3Cl) fenolan sodu
W celu ich identyfikacji przeprowadzono opisane poniżej doświadczenia.
1. Do próbek pobranych z probówek I i II dodano kwas solny, ale w żadnym naczyniu nie zaobserwowano zmian.
2. Z probówek I i II pobrano próbki i wprowadzono do nich wodny roztwór oranżu metylowego. Otrzymano roztwory o różnych barwach. W naczyniu z próbką pobraną z probówki I roztwór przyjął barwę czerwoną.
Napisz w formie jonowej skróconej równanie reakcji, która decyduje o odczynie wodnego roztworu substancji znajdującej się w probówce I.
Określenie liczb reszt aminokwasów budujących tripeptyd. Zadanie 34. Arkusz CKE chemia maj 2021 rozszerzony (2 punkty)
Próbkę pewnego tripeptydu o masie 43,4 mg poddano całkowitej hydrolizie w stężonym kwasie solnym. Po odparowaniu uzyskanego roztworu do sucha otrzymano mieszaninę związków jonowych o wzorach:
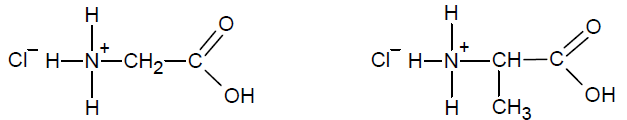
Uzyskaną w opisany sposób mieszaninę rozpuszczono w wodzie i dodano do niej nadmiar wodnego roztworu azotanu(V) srebra. Zaszła wtedy reakcja opisana równaniem:
Ag+ + Cl– → AgCl.
Wytrącony osad AgCl odsączono, wysuszono i zważono. Jego masa była równa 86,1 mg.
Określ, z ilu reszt glicyny 𝒙 i z ilu reszt alaniny 𝒚 składała się jedna cząsteczka badanego tripeptydu. Napisz wzór tripeptydu w postaci Gly𝒙Ala𝒚. Przyjmij masę molową chlorku srebra M AgCl = 143,5 g ∙ mol–1. Wzór tripeptydu:
Zapis sekwencji możliwych oligopeptydów powstałych z cysteiny oraz leucyny. Zadanie 35. Arkusz CKE chemia maj 2021 rozszerzony (1 punkt)
W wyniku kondensacji z jednej cząsteczki cysteiny (Cys) i dwóch cząsteczek leucyny (Leu) mogą powstać różne tripeptydy.
Napisz wszystkie możliwe sekwencje aminokwasów w tripeptydach o budowie liniowej – zastosuj trzyliterowe kody aminokwasów. Sekwencje aminokwasów w tripeptydach:
Opis zmian, jakie mogłyby pozwolić lub nie na odróżnienie próbek roztworów czterech związków chemicznych. Zadanie 36. Arkusz CKE chemia maj 2021 rozszerzony (2 punkty)
Do czterech probówek zawierających niebieską zalkalizowaną zawiesinę świeżo strąconego wodorotlenku miedzi(II) wprowadzono bezbarwne wodne roztwory czterech różnych związków – do każdej probówki roztwór innej substancji. Zawartość każdej probówki wymieszano. Przebieg doświadczenia zilustrowano na poniższym rysunku.
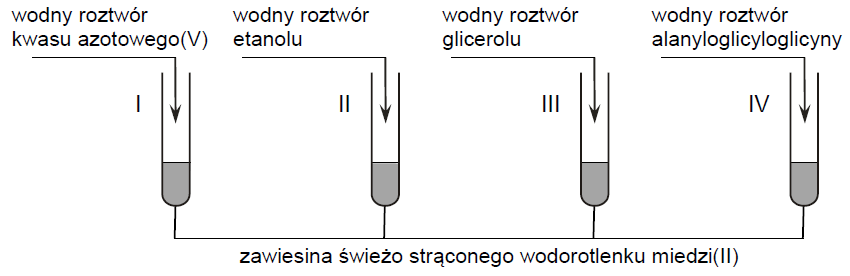
Rozstrzygnij, czy zmiany zaobserwowane podczas doświadczenia umożliwiają potwierdzenie, że do danej probówki wprowadzono roztwór wskazany na rysunku. Odpowiedź uzasadnij. W uzasadnieniu opisz możliwe do zaobserwowania zmiany zawartości probówek, uwzględnij rodzaj (roztwór, zawiesina) oraz barwę mieszaniny otrzymanej po dodaniu roztworu danej substancji do każdej probówki. Rozstrzygnięcie: Uzasadnienie: Probówka I: Probówka II: Probówka III: Probówka IV: