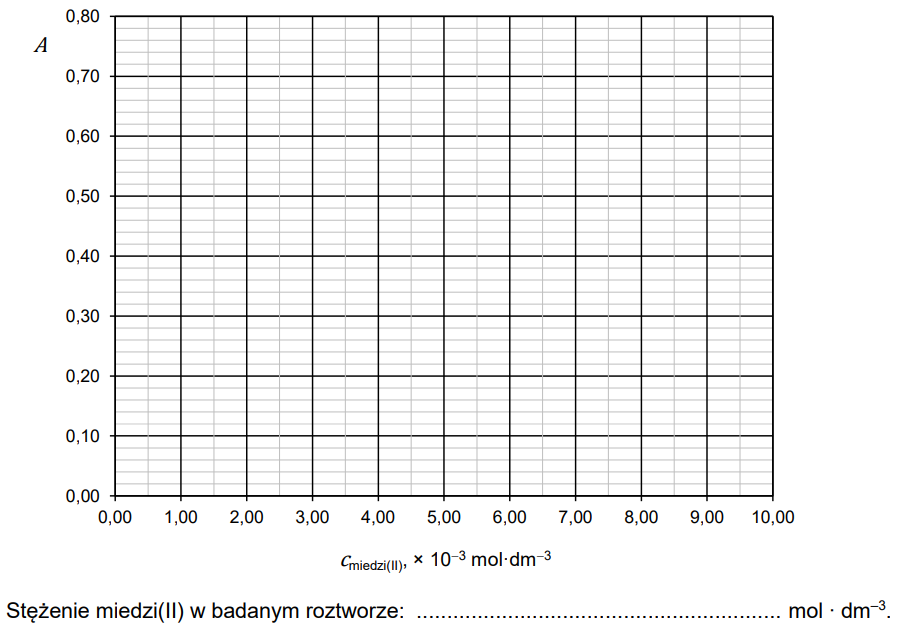
Zapis wzorów sumarycznych jonów kompleksowych miedzi(II). Zadanie 16. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
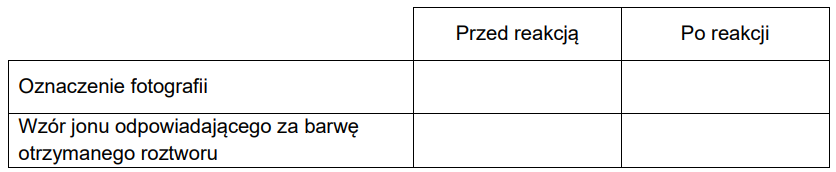
Jony miedzi(II) tworzą wiele różnych związków kompleksowych. W roztworze wodnym nie występują w postaci prostych kationów Cu2+, lecz jako jony uwodnione, czyli akwakompleksy. W akwakompleksie jon miedzi(II) przyjmuje liczbę koordynacyjną równą 6. Ten kompleks jest mniej trwały niż kompleks miedzi(II) z amoniakiem, dlatego w obecności amoniaku o odpowiednim stężeniu w roztworze związku miedzi(II) tworzy się aminakompleks, w którym liczba koordynacyjna jonu Cu2+ także jest równa 6, ale cztery cząsteczki wody są zastąpione czterema cząsteczkami amoniaku. Nosi on nazwę jonu diakwatetraaminamiedzi(II). Obecność tych jonów nadaje roztworowi ciemnoniebieską barwę. Roztwory, w których obecne są opisane jony kompleksowe, przedstawiono na poniższych fotografiach.

Napisz wzory opisanych jonów kompleksowych: akwakompleksu miedzi(II) oraz jonu diakwatetraaminamiedzi(II). Wzór akwakompleksu miedzi(II): Wzór jonu diakwatetraaminamiedzi(II):
Zapis równania reakcji chemicznej, której przebieg spowodował odbarwienie roztworu. Zadanie 19. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Wykonano doświadczenie, którego celem było otrzymanie pewnej substancji chemicznej. Postępowano zgodnie z poniższą instrukcją:
Odważyć 5 g CuSO4·5H2O, umieścić w kolbie stożkowej i dodać 15 cm3 wody destylowanej. Roztwór w kolbie mieszać i ogrzać w łaźni wodnej do temperatury około 60 oC. W tej temperaturze dodawać powoli porcjami nadmiar pyłu cynkowego (ok. 1,5 g). Po wprowadzeniu całej ilości cynku kolbę dalej ogrzewać do momentu odbarwienia roztworu. Następnie otrzymaną mieszaninę przesączyć i osad przemyć rozcieńczonym kwasem solnym (0,5 mol · dm–3).
Napisz w formie jonowej skróconej równanie reakcji, która była przyczyną odbarwienia roztworu, i wyjaśnij, w jakim celu otrzymany osad należy przemyć rozcieńczonym kwasem solnym. Równanie zachodzącej reakcji: Wyjaśnienie:
Zapis równania reakcji przebiegającej w pracującym ogniwie chemicznym. Zadanie 20. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
W standardowym półogniwie A ustala się równowaga opisana równaniem:
MnO4− + 8H+ + 5ē ⇄ Mn2+ + 4H2O
Po połączeniu tego półogniwa ze standardowym półogniwem B otrzymano ogniwo, którego siła elektromotoryczna (SEM) jest równa 0,971 V.
Napisz sumaryczne równanie reakcji, która zachodzi w pracującym ogniwie zbudowanym z półogniw A i B.
Obliczanie iloczynu rozpuszczalności bromku srebra korzystając z potencjału elektrody bromosrebrowej. Zadanie 21. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (2 punkty)
Przykładem elektrody halogenosrebrowej jest elektroda bromosrebrowa, której działanie opisano równaniem:
AgBr (s) + ē ⇄ Ag (s) + Br– (aq)
Potencjał tej elektrody zależy od stężenia jonów bromkowych i w temperaturze 298 K wyraża się równaniem:
![]()
Standardowy potencjał tej elektrody EoAg/AgBr = 0,071 V.
W temperaturze 298 K potencjał elektrody bromosrebrowej zanurzonej w wodnym roztworze bromku srebra pozostającym w równowadze z osadem tej soli był równy EAg/AgBr = 0,431 V.
Oblicz wartość iloczynu rozpuszczalności bromku srebra Ks [AgBr] w temperaturze 298 K.
Zapis równania reakcji otrzymywania węglowodoru. Zadanie 22.1. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
O dwóch węglowodorach A i B, z których każdy ma wzór sumaryczny C6H12, wiadomo, że:
– węglowodór A powstaje w wyniku reakcji między 3-bromo-2,2-dimetylobutanem a alkoholowym roztworem wodorotlenku sodu przebiegającej w podwyższonej temperaturze;
– węglowodór B, będący alkanem cyklicznym, powstaje w reakcji zachodzącej pomiędzy dibromopochodną heksanu a cynkiem, a w jego cząsteczce obecny jest jeden trzeciorzędowy atom węgla połączony m.in. z grupą metylową.
Napisz w formie jonowej skróconej równanie reakcji otrzymywania węglowodoru A. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Zapis wzoru grupowego oraz nazwy systematycznej węglowodoru. Zadanie 22.2. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
O dwóch węglowodorach A i B, z których każdy ma wzór sumaryczny C6H12, wiadomo, że:
– węglowodór A powstaje w wyniku reakcji między 3-bromo-2,2-dimetylobutanem a alkoholowym roztworem wodorotlenku sodu przebiegającej w podwyższonej temperaturze;
– węglowodór B, będący alkanem cyklicznym, powstaje w reakcji zachodzącej pomiędzy dibromopochodną heksanu a cynkiem, a w jego cząsteczce obecny jest jeden trzeciorzędowy atom węgla połączony m.in. z grupą metylową.
Narysuj wzór półstrukturalny (grupowy) lub uproszczony węglowodoru B oraz napisz jego nazwę systematyczną. Wzór grupowy: Nazwa systematyczna:
Rysowanie wzorów monochloropochodnych naftalenu. Zadanie 23.1. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Naftalen to organiczny związek chemiczny o wzorze sumarycznym C10H8, będący najprostszym policyklicznym węglowodorem aromatycznym o dwóch skondensowanych pierścieniach. Jego wzór przedstawiono poniżej.
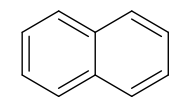
Naftalen ma właściwości podobne do benzenu, np. ulega analogicznym reakcjom chemicznym, jednak w przeciwieństwie do benzenu ten związek dość łatwo utlenia się pod wpływem silnych utleniaczy.
W reakcji monochlorowania naftalenu powstają dwa izomeryczne produkty.
Narysuj wzory półstrukturalne (grupowe) lub uproszczone dwóch izomerycznych monochloropochodnych naftalenu, które powstają w reakcji tego związku z chlorem, przebiegającej w obecności odpowiedniego katalizatora.
Wybór właściwych określeń dotyczących reakcji z udziałem naftalenu. Zadanie 23.2. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (1 punkt)
Naftalen to organiczny związek chemiczny o wzorze sumarycznym C10H8, będący najprostszym policyklicznym węglowodorem aromatycznym o dwóch skondensowanych pierścieniach. Jego wzór przedstawiono poniżej.

Naftalen ma właściwości podobne do benzenu, np. ulega analogicznym reakcjom chemicznym, jednak w przeciwieństwie do benzenu ten związek dość łatwo utlenia się pod wpływem silnych utleniaczy.
W reakcji monochlorowania naftalenu powstają dwa izomeryczne produkty.
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Monochlorowanie naftalenu jest przykładem reakcji (substytucji / addycji / eliminacji) przebiegającej według mechanizmu (rodnikowego / elektrofilowego / nukleofilowego). Funkcję katalizatora w tej reakcji mogą pełnić (związki żelaza(III) / jony OH–).
Przypisywanie wartości stopni utlenienia atomom węgla. Zadanie 24. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (2 punkty)
Naftalen to organiczny związek chemiczny o wzorze sumarycznym C10H8, będący najprostszym policyklicznym węglowodorem aromatycznym o dwóch skondensowanych pierścieniach. Jego wzór przedstawiono poniżej.

Naftalen ma właściwości podobne do benzenu, np. ulega analogicznym reakcjom chemicznym, jednak w przeciwieństwie do benzenu ten związek dość łatwo utlenia się pod wpływem silnych utleniaczy.
W odpowiednich warunkach naftalen może zostać utleniony zgodnie z poniższym schematem:
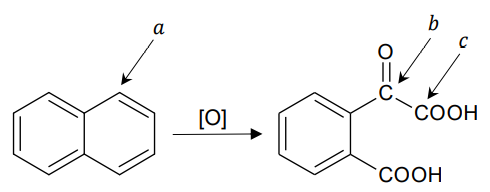
W tej reakcji powstaje również tlenek węgla(IV).
Na podstawie: A. Daly, The oxidation of naphthalene to phthalonic acid by alkaline solutions of permanganate; J. Phys. Chem. 11 (2), (1907), 93.
Uzupełnij tabelę – wpisz formalny stopień utlenienia: atomu węgla oznaczonego literą 𝒂 we wzorze cząsteczki naftalenu oraz atomów węgla oznaczonych literami 𝒃 i 𝒄 we wzorze produktu reakcji. Napisz, ile moli elektronów oddaje 1 mol naftalenu w opisanym procesie utlenienia. Liczba moli elektronów:
Ustalenie wzorów grupowych związków chemicznych na podstawie ciągu przemian. Zadanie 26.1. Arkusz CKE chemia pokazowy marzec 2022 rozszerzony (2 punkty)
Związki metaloorganiczne, czyli takie, w których atom metalu jest związany kowalencyjnie z atomem węgla grupy alkilowej lub arylowej, są szeroko wykorzystywane w syntezie organicznej. Do najczęściej stosowanych należą tzw. związki Grignarda o wzorze ogólnym:
R–Mg–X
W tym wzorze R oznacza grupę alkilową lub arylową, a X jest atomem fluorowca, najczęściej bromu lub jodu. Te związki otrzymuje się w reakcji odpowiednich fluorowcopochodnych alkilowych lub arylowych z magnezem w roztworze bezwodnego etoksyetanu (eteru dietylowego):
R–X + Mg → R–Mg–X
Związki Grignarda reagują m.in. z aldehydami i ketonami, zgodnie ze schematem:
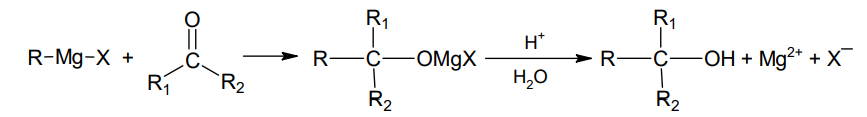
W pierwszym etapie powstaje sól halogenomagnezowa alkoholu, która w wyniku działania wodnego roztworu mocnego kwasu daje wolny alkohol oraz jony magnezowe i halogenkowe.
W celu otrzymania 3-fenylopentan-3-olu przy użyciu związków Grignarda przeprowadzono reakcje zgodnie z poniższym schematem:
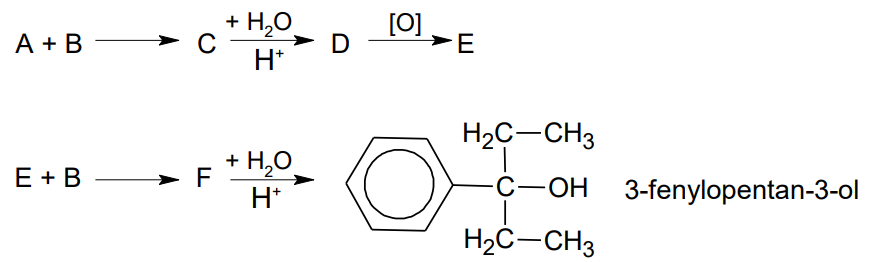
W roztworze wodnym po reakcjach były obecne jony bromkowe.
Uzupełnij tabelę. Napisz wzory półstrukturalne (grupowe) związków A, B, D i E. Wzór związku A: Wzór związku B: Wzór związku D: Wzór związku E: