Jedną z przemysłowych metod wytwarzania cynku jest redukcja jego tlenku:
ZnO + C → Zn + CO
W trakcie prowadzonego procesu przebiegają również dwie wpływające na jego całkowitą wydajność reakcje chemiczne:
Reakcja A: ZnO(s) + CO(g) ⇄ Zn(g) + CO2(g)
Reakcja B: CO2(g) + C(s) ⇄ 2CO(g)
Rysunek poniżej ilustruje charakterystyki zmian równowagowego składu fazy gazowej złożonej z CO oraz CO2 pod ciśnieniem 0,1 MPa dla reakcji A oraz B. Zakreskowane pole nad krzywą A obrazuje obszar trwałości cynku, natomiast pole pod tą krzywą jest obszarem trwałości ZnO.
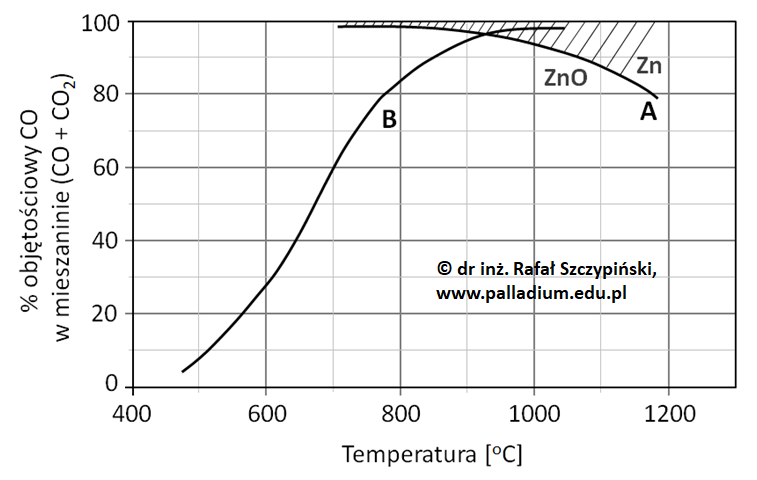
Z zamieszczonych charakterystyk wynika, że w temperaturze powyżej 930 oC stężenie równowagowe CO jest dostatecznie wysokie, aby mogła przebiegać reakcja A.
Na podstawie: K. Schmidt-Szałowski, M. Szafran, E. Bobryk, J. Sentek, Technologia chemiczna.Przemysł nieorganiczny, Warszawa 2013.
Stałe równowag reakcji biegnących z udziałem reagentów gazowych często przedstawia się przy użyciu równowagowych ciśnień cząstkowych takich substancji (ciśnień w stanie równowagi). Ciśnienie cząstkowe (pi) gazowego składnika w mieszaninie gazów opisuje równanie:
pi = xi ∙ p
W wyrażeniu tym wielkość p jest ciśnieniem całkowitym mieszaniny gazów, natomiast xi jest ułamkiem molowym jej składnika, który definiuje się jako stosunek liczby moli tego składnika do sumarycznej liczby moli wszystkich składników mieszaniny.
Na podstawie: K. Schmidt-Szałowski, M. Szafran, E. Bobryk, J. Sentek, Technologia chemiczna. Przemysł nieorganiczny, Warszawa 2013 oraz D. Mickiewicz, Podstawy obliczeń chemicznych. Część I, Łódź 2019.
Ciśnieniowe stałe równowag – reakcji A (KA) oraz reakcji B (KB) w temperaturze T opisują wyrażenia:

Z równań przedstawiających stałe równowag reakcji A oraz B można wyznaczyć równowagowe ciśnienie cząstkowe par cynku znajdujących się w układzie podczas prowadzonego procesu.
Na podstawie wyprowadzonego wyrażenia oraz niezbędnych obliczeń ustal, jak zmieni się równowagowe ciśnienie cząstkowe par cynku, gdy równowagowe ciśnienie cząstkowe CO2 w temperaturze T wzrośnie czterokrotnie?
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone