Elektrolizę tlenku glinu prowadzi się w temperaturze około 950 oC, po jego rozpuszczeniu w kriolicie (Na3AlF6), który powstaje w wyniku stapiania mieszaniny fluorków – sodu oraz glinu, zmieszanych w stosunku molowym 3:1. W praktyce jednak elektrolizę prowadzi się w elektrolicie, w którym stosunek molowy wymienionych fluorków wynosi 2,7:1. Dzięki takiemu zabiegowi temperatura topnienia elektrolitu jest niższa niż czystego kriolitu. Podczas procesu elektrolizy w zastosowanym elektrolicie tlenek glinu ulega dysocjacji:
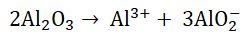
Na katodzie redukcji ulegają jony Al3+, natomiast na węglowej anodzie przebiega proces:
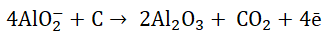
Glin praktycznie nie rozpuszcza się w zastosowanym elektrolicie, dlatego w warunkach prowadzonego procesu powstały w wyniku elektrolizy ciekły metal samorzutnie spływa na dno elektrolizera, a następnie jest z niego usuwany.
Techniczny tlenek glinu przed wprowadzeniem do elektrolizera zawiera znaczne ilości wilgoci. W celu jej usunięcia, próbka zostaje poddana prażeniu. Pomimo takiego zabiegu zdarza się, że śladowe ilości wody pozostają w jego strukturze krystalicznej lub dostają się do elektrolizera razem z niedostatecznie wysuszonym powietrzem. Dochodzi wtedy do reakcji wody z kriolitem, co jest niepożądane z uwagi na uwalnianie się toksycznego dla środowiska fluorowodoru oraz powstawanie fluorku sodu, którego zwiększona ilość znacząco wpływa na temperaturę topnienia elektrolitu. Trzecim produktem opisanej reakcji kriolitu z wodą jest tlenek glinu.
Na podstawie: K. Schmidt-Szałowski, M. Szafran, E. Bobryk, J. Sentek, Technologia chemiczna. Przemysł nieorganiczny, Warszawa 2013.
Wraz ze zmianą stanu skupienia substancji chemicznych zmienia się ich gęstość. W temperaturze 25 oC pod ciśnieniem normalnym glin oraz kriolit są ciałami stałymi, a ich gęstości wynoszą (odpowiednio) 2,7 g∙cm–3 i 2,9 g∙cm–3.
Oceń, czy w warunkach prowadzonego procesu elektrolitycznego gęstość glinu jest większa, czy mniejsza od gęstości elektrolitu? Uzasadnij odpowiedź.
Ocena:
Uzasadnienie:
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone