W określonych warunkach wodoroaniony mogą być klasyfikowane jako kwasy Brønsteda. Miarą mocy tych kwasów jest wielkość zwana stałą równowagi dysocjacji kwasowej (Ka). W tabeli poniżej zebrano dane na temat wartości stałych dysocjacji (Ka) w temperaturze 25 oC kilku wybranych wodoroanionów.
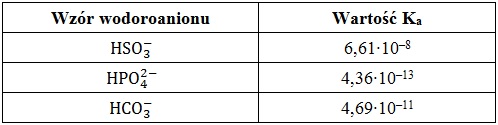
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2018. oraz W. Mizerski, Tablice chemiczne, Warszawa 2013.
W trzech kolejno ponumerowanych (1–3) kolbach miarowych o pojemności 250 cm3 rozpuszczono w 200 cm3 wody destylowanej po 0,01 mola wodorosoli, przy czym były to odpowiednio KHSO3, K2HPO4, KHCO3. Każdy z uzyskanych roztworów uzupełniono następnie wodą destylowaną „do kreski”.
Zawartość probówek, w których znajdują się wodne roztwory KHSO3 oraz KHCO3 można odróżnić prowadząc reakcję chemiczną z udziałem nadmiaru jednego spośród odczynników:
Ba(OH)2(aq), KOH(aq), HCl(aq).
Podkreśl wzór jednego spośród trzech wyżej wymienionych odczynników, którego należy użyć, w celu odróżnienia opisanych roztworów wodorosoli. Napisz obserwacje, jakie stanowić będą podstawę identyfikacji każdego z roztworów po dodaniu wybranego odczynnika.
Probówka z roztworem KHSO3:
Probówka z roztworem KHCO3:
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone