Przemysłowy proces produkcji fenolu oraz acetonu metodą kumenową odbywa się w trzech zasadniczych etapach (I–III), podczas których biegną liczne reakcje elementarne.
Etap I: Alkilowanie benzenu z wykorzystaniem, propylenu oraz chlorowodoru w obecności katalizatora (AlCl3), co prowadzi do powstania kumenu (izopropylobenzenu).
Etap II: Katalityczne utlenianie kumenu tlenem z powierza, prowadzące do powstania wodoronadtlenku kumenu (WNTK) – organicznego związku chemicznego, którego wzór półstrukturalny cząsteczki przedstawia rysunek poniżej.
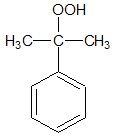
Etap III: Rozkład wodoronadtlenku kumenu z utworzeniem fenolu oraz acetonu.
Na podstawie: E. Grzywa, J. Molenda, Technologia podstawowych syntez organicznych. Tom 2, Warszawa 2008.
W pierwszym etapie metody kumenowej przebiegają między innymi dwie główne reakcje chemiczne. Produktem pierwszej z nich jest monochloropochodna alkilowa, która powstaje zgodnie z regułą Markownikowa. Związek ten wykorzystuje się następnie w reakcji alkilowania aromatycznego pierścienia benzenu w obecności kwasu Lewisa – AlCl3 (druga reakcja).
Określ do jakich typów reakcji (substytucja, addycja, eliminacja) należą oraz według jakich mechanizmów przebiegają (nukleofilowy, rodnikowy, elektrofilowy) procesy – tworzenia monochloropochodnej alkilowej oraz alkilowania benzenu? Uzupełnij tabelę.

© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone