Zapis symbolu pierwiastka chemicznego oraz określenie bloku energetycznego na podstawie skróconej konfiguracji elektronowej kationu. Zadanie 1.1. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Konfigurację elektronową dwudodatniego kationu pierwiastka X przedstawia zapis: [Ar] 3d10.
Uzupełnij poniższą tabelę. Wpisz symbol chemiczny pierwiastka X, numer grupy oraz symbol bloku konfiguracyjnego, do którego należy ten pierwiastek.
Zapis klatkowy pełnej konfiguracji elektronowej rozszyfrowanego pierwiastka. Zadanie 1.2. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Konfigurację elektronową dwudodatniego kationu pierwiastka X przedstawia zapis: [Ar] 3d10.
Uzupełnij poniższy schemat. Przedstaw pełną konfigurację elektronową atomu (w stanie podstawowym) pierwiastka X. Zastosuj schemat klatkowy. W zapisie uwzględnij numery powłok i symbole podpowłok.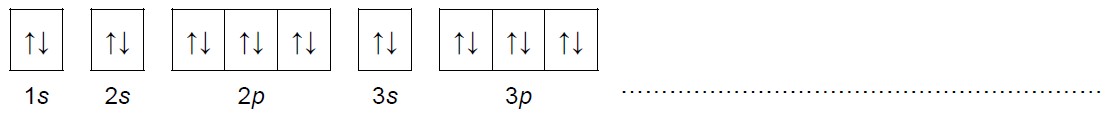
Wyjaśnienie, dlaczego energia jonizacji wodoru jest dużo większa niż pozostałych pierwiastków pierwszej grupy układu okresowego. Zadanie 2. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Pierwsza energia jonizacji (Ej1) to minimalna energia potrzebna do oderwania pierwszego elektronu od obojętnego atomu. Każda następna energia jonizacji (Ej2, Ej3 itd.) to energia potrzebna do oderwania kolejnego elektronu od coraz bardziej dodatnio naładowanej drobiny. Wartości energii jonizacji zmieniają się okresowo w miarę wzrostu liczby atomowej. W tabeli podano wartość pierwszej energii jonizacji dla atomu wodoru i wartości kilku wybranych energii jonizacji dla atomów kolejnych pierwiastków pierwszej grupy układu okresowego.
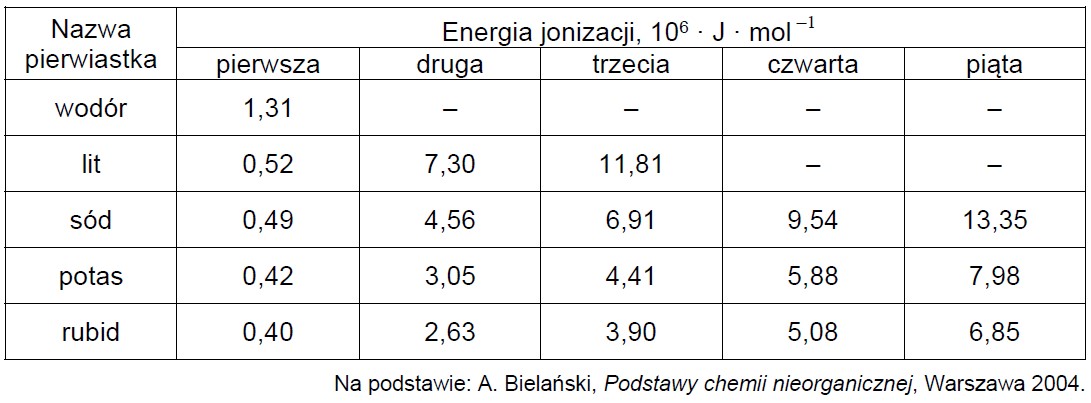
Wyjaśnij, dlaczego wartość pierwszej energii jonizacji atomu wodoru jest dużo większa niż wartość pierwszej energii jonizacji atomów kolejnych pierwiastków pierwszej grupy.
Wybór poprawnych określeń w nawiasach, w zdaniach dotyczących energii jonizacji. Zadanie 3. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Pierwsza energia jonizacji (Ej1) to minimalna energia potrzebna do oderwania pierwszego elektronu od obojętnego atomu. Każda następna energia jonizacji (Ej2, Ej3 itd.) to energia potrzebna do oderwania kolejnego elektronu od coraz bardziej dodatnio naładowanej drobiny. Wartości energii jonizacji zmieniają się okresowo w miarę wzrostu liczby atomowej. W tabeli podano wartość pierwszej energii jonizacji dla atomu wodoru i wartości kilku wybranych energii jonizacji dla atomów kolejnych pierwiastków pierwszej grupy układu okresowego.

Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie. Pierwsza energia jonizacji litowca jest (mniejsza / większa) niż druga energia jonizacji, ponieważ: oraz • przyciąganie przez jądro elektronu z przedostatniej powłoki jest (silniejsze / słabsze) niż przyciąganie elektronu z powłoki ostatniej.
• (łatwiej / trudniej) oderwać elektron od jonu naładowanego dodatnio niż od obojętnego atomu
Ocena poprawności zdań dotyczących energii jonizacji pierwiastków. Zadanie 4. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Pierwsza energia jonizacji (Ej1) to minimalna energia potrzebna do oderwania pierwszego elektronu od obojętnego atomu. Każda następna energia jonizacji (Ej2, Ej3 itd.) to energia potrzebna do oderwania kolejnego elektronu od coraz bardziej dodatnio naładowanej drobiny. Wartości energii jonizacji zmieniają się okresowo w miarę wzrostu liczby atomowej. W tabeli podano wartość pierwszej energii jonizacji dla atomu wodoru i wartości kilku wybranych energii jonizacji dla atomów kolejnych pierwiastków pierwszej grupy układu okresowego.

Oceń, czy podane poniżej informacje są prawdziwe. Zaznacz P, jeśli informacja jest prawdziwa, albo F – jeśli jest fałszywa. 1. W grupie pierwiastków: lit, sód i rubid, obserwujemy, że im mniejsza elektroujemność, tym większa jest wartość pierwszej energii jonizacji. 2. W grupie pierwiastków: sód, potas i rubid, obserwujemy, że im większy promień atomu, tym mniejsza jest wartość pierwszej energii jonizacji. 3. Wartości czwartej i piątej energii jonizacji potasu dotyczą elektronów należących do różnych powłok.
Obliczanie rozpuszczalności sacharozy w temperaturze 80 stopni Celsjusza. Zadanie 5. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Sacharoza dobrze rozpuszcza się w wodzie, a jej rozpuszczalność w dużym stopniu zależy od temperatury.
Przygotowano nasycony wodny roztwór sacharozy w temperaturze 80 °C. Następnie ochłodzono go do temperatury 20 °C i stwierdzono, że wykrystalizowało 1590 g sacharozy, a roztwór, który pozostał po krystalizacji, miał masę 3040 g.
Oblicz rozpuszczalność sacharozy (w gramach na 100 gramów wody) w temperaturze 80 °C, jeśli w temperaturze 20 °C jest ona równa 204 g na 100 g wody. Na podstawie: W. Mizerski, Małe tablice chemiczne, Warszawa 1997.
Wybór poprawnych określeń dotyczących katalizatora. Zadanie 6. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie. Działanie katalizatora prowadzi do (obniżenia / podwyższenia) energii aktywacji katalizowanej reakcji. Obecność katalizatora (wpływa / nie wpływa) na wydajność procesu. Katalizatory (zmieniają szybkość / nie zmieniają szybkości), z jaką układ osiąga stan równowagi.
Wybór poprawnych określeń dotyczących reguły przekory w reakcji syntezy amoniaku. Zadanie 7. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Poniżej przedstawiono równanie reakcji syntezy amoniaku.
N2 + 3H2 ⇄ 2NH3 ΔH = -91,8 kJ
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie. Wzrost temperatury w układzie reakcyjnym poskutkuje (spadkiem / wzrostem) wydajności syntezy amoniaku. Dodanie do reaktora większej ilości wodoru przyczyni się do (spadku / wzrostu) ilości amoniaku w mieszaninie poreakcyjnej. Obniżenie ciśnienia w układzie reakcyjnym poskutkuje (spadkiem / wzrostem) wydajności syntezy amoniaku.
Ustalanie wzoru hydratu na podstawie przeprowadzonej reakcji chemicznej. Zadanie 8. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Siarczan(VI) sodu tworzy hydraty o różnym składzie. Próbkę jednego z hydratów tej soli, o masie 8,050 g, rozpuszczono w wodzie i otrzymano 100,0 cm3 roztworu, po czym dodano do niego 50,0 cm3 roztworu azotanu(V) baru o stężeniu 0,600 mol·dm–3. Wytrącony osad siarczanu(VI) baru po odsączeniu i wysuszeniu miał masę 5,825 g.
Ustal wzór hydratu siarczanu(VI) sodu użytego w opisanym doświadczeniu. Przyjmij, że opisane przemiany przebiegły z wydajnością równą 100%, a masy molowe są równe: MNa2SO4 = 142 g·mol–1 MBaSO4 = 233 g·mol–1
Wyjaśnienie większej aktywności metalu z pośród wapnia i magnezu. Zadanie 9. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Do dwóch zlewek zawierających jednakowe objętości wody o temperaturze t = 20 °C dodano:
• do zlewki I – próbkę metalicznego magnezu
• do zlewki II – próbkę metalicznego wapnia.
Tylko w jednej zlewce zaobserwowano objawy reakcji chemicznej.
Napisz w formie jonowej równanie reakcji zachodzącej podczas opisanego doświadczenia. Wyjaśnij przyczynę różnej aktywności chemicznej badanych metali. Równanie reakcji: Wyjaśnienie:
Uszeregowanie soli według wzrastającego pH ich wodnych roztworów. Zadanie 10. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Przygotowano wodne roztwory czterech soli: azotanu(V) sodu, fluorku sodu, chlorku amonu i azotanu(III) amonu, o takim samym stężeniu molowym równym 0,1 mol∙dm–3.
Napisz wzory sumaryczne tych soli w kolejności wzrastającego pH ich wodnych roztworów.
Zapis równania reakcji zachodzącej w wodnym roztworze chlorku amonu. Zadanie 11.1. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Przygotowano wodne roztwory czterech soli: azotanu(V) sodu, fluorku sodu, chlorku amonu i azotanu(III) amonu, o takim samym stężeniu molowym równym 0,1 mol∙dm–3.
Napisz w formie jonowej skróconej równanie reakcji zachodzącej w roztworze chlorku amonu.
Wskazanie jaką rolę pełni woda w teorii Brønsteda w wodnym roztworze fluorku sodu. Zadanie 11.2. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (1 punkt)
Przygotowano wodne roztwory czterech soli: azotanu(V) sodu, fluorku sodu, chlorku amonu i azotanu(III) amonu, o takim samym stężeniu molowym równym 0,1 mol∙dm–3.
Określ, jaką funkcję (kwasu czy zasady Brønsteda) pełni woda w reakcji zachodzącej w roztworze fluorku sodu.
Obliczanie pH roztworu kwasu solnego. Zadanie 12. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Odmierzono 10,0 cm3 kwasu solnego o stężeniu c = 10,0% masowych i gęstości d = 1,05 g · cm–3, a następnie rozcieńczono ten kwas wodą destylowaną do objętości 750 cm3.
Na podstawie: J. Sawicka, A. Janich-Kilian, W. Cejner-Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2015.
Oblicz pH otrzymanego roztworu. Wynik końcowy zaokrąglij do pierwszego miejsca po przecinku.
Określanie charakteru chemicznego wodorotlenku glinu z zapisem równań reakcji chemicznych. Zadanie 13. Arkusz CKE chemia marzec 2021 próbny test diagnostyczny rozszerzony (2 punkty)
Poniższy wykres przedstawia zależność rozpuszczalności molowej – czyli stężenia molowego substancji w jej roztworze nasyconym – wodorotlenku glinu od pH roztworu wodnego w temperaturze 25 °C. W tym ujęciu rozpuszczalność związku uwzględniła powstawanie rozpuszczalnych produktów reakcji, jakim ten związek ulega w zależności od pH roztworu.
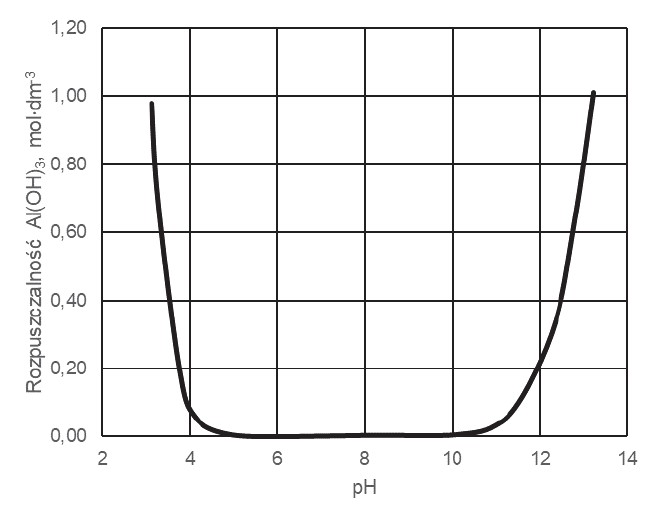
Na podstawie: G. Charlot, Analiza nieorganiczna jakościowa, Warszawa 1976.
Napisz, jaka właściwość chemiczna wodorotlenku glinu decyduje o zmianach rozpuszczalności tego związku przedstawionych na wykresie. Napisz w formie jonowej skróconej równania reakcji potwierdzające charakter chemiczny wodorotlenku glinu. Charakter chemiczny: Równania reakcji: