Ocena, czy wykorzystując próbę Tollensa możliwe jest odróżnienie glukozy od fruktozy. Zadanie 27. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
W roztworze o odczynie zasadowym ketony, których cząsteczki zawierają grupę hydroksylową –OH przy atomie węgla połączonym z atomem węgla grupy karbonylowej (α-hydroksyketony), ulegają izomeryzacji. Przemianę tę ilustruje poniższy schemat.
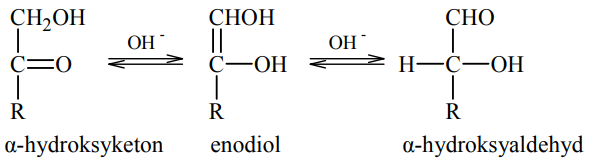
Oceń, czy za pomocą próby Tollensa można odróżnić glukozę od fruktozy. Odpowiedź uzasadnij.
Wskazanie cukrów dających pozytywny wynik próby Tollensa. Zadanie 28. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Poniżej przedstawiono wzory (w projekcji Hawortha) ilustrujące budowę wybranych mono i disacharydów.
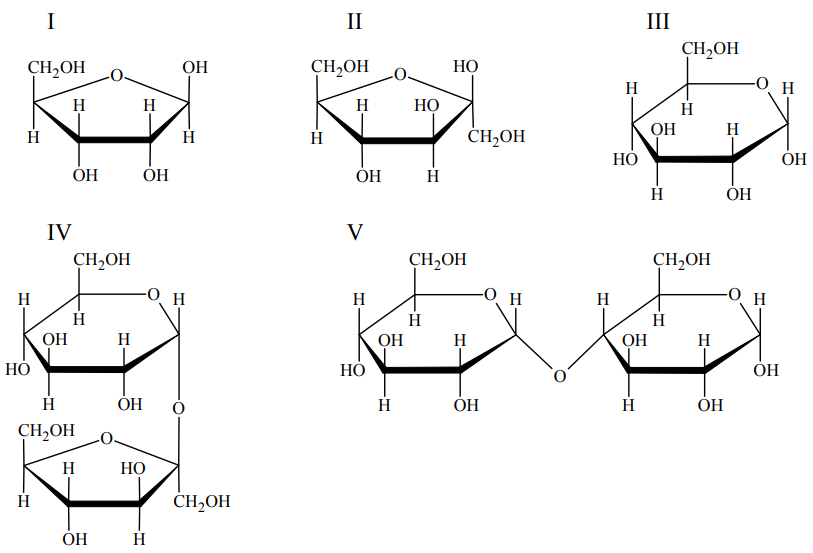
Wskaż wszystkie sacharydy, które dają pozytywny wynik próby Tollensa. Numery wzorów wybranych sacharydów:
Bilans jonowo-elektronowy reakcji glukozy z odczynnikiem Tollensa. Zadanie 29ab. Arkusz CKE chemia maj 2012 rozszerzony (3 punkty)
Reakcja glukozy z odczynnikiem Tollensa przebiega zgodnie z poniższym schematem:
CH2OH–(CHOH)4–CHO + Ag(NH3)2+ + OH– → CH2OH–(CHOH)4–COO– + Ag + NH3 + H2O
a) Napisz w formie jonowej z uwzględnieniem pobranych lub oddanych elektronów (zapis jonowo-elektronowy) równania procesów redukcji i utleniania. Równanie procesu redukcji: Równanie procesu utleniania: b) Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.![]()
Zapis wzoru sumarycznego alkanu oraz wzorów grupowych i nazw jego dwóch monochloropochodnych. Zadanie 30ab. Arkusz CKE chemia maj 2012 rozszerzony (3 punkty)
Pewien alkan o rozgałęzionym łańcuchu węglowym poddano chlorowaniu, otrzymując dwie izomeryczne monochloropochodne o masie molowej M = 92,5 g·mol–1.
a) Napisz wzór sumaryczny alkanu poddanego chlorowaniu. b) Napisz wzory półstrukturalne (grupowe) obu otrzymanych monochloropochodnych tego alkanu oraz podaj ich nazwy systematyczne.
Wskazanie alkenu o największej trwałości oraz alkenu o najmniejszej trwałości. Zadanie 31. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Porównanie efektu cieplnego reakcji katalitycznego uwodornienia alkenów pozwala na porównanie trwałości tych związków. Im mniej ciepła wydziela się w reakcji uwodornienia jednego mola danego alkenu, tym jest on trwalszy. Tak określona trwałość alkenów układa się w następujący szereg:
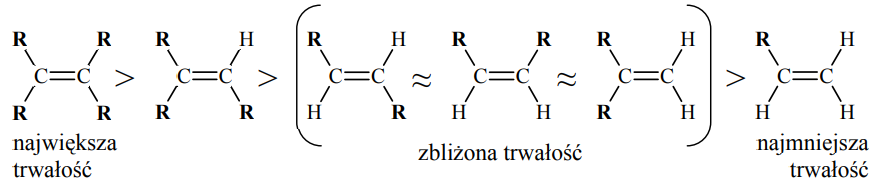
R oznacza grupę alkilową.
Na podstawie: John McMurry: Chemia organiczna, Warszawa 2000
Spośród alkenów o wzorze sumarycznym C6H12 wskaż alken o największej trwałości oraz alken o najmniejszej trwałości. Narysuj wzory półstrukturalne (grupowe) tych alkenów.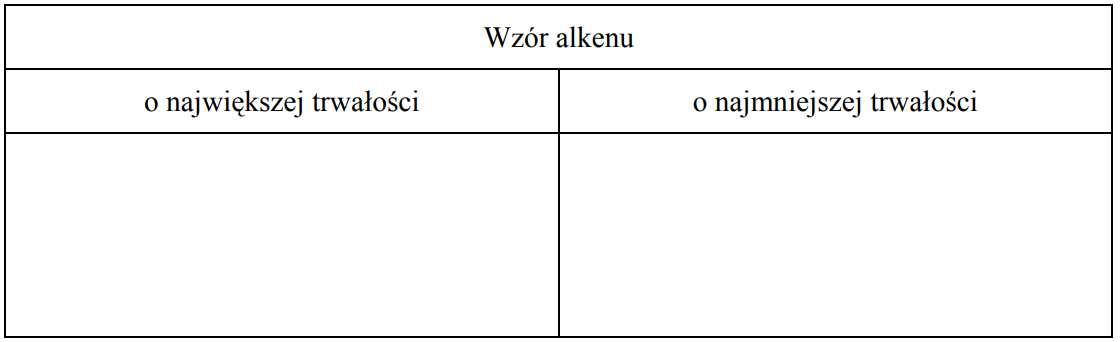
Wybór poprawnych określeń dotyczących glicerolu. Zadanie 32. Arkusz CKE chemia maj 2012 rozszerzony (2 punkty)
Uzupełnij poniższą charakterystykę glicerolu (propano-1,2,3-triolu), wybierając jedno określenie spośród podanych w każdym nawiasie. Wybrane określenia podkreśl.
1. W warunkach panujących w laboratorium glicerol jest cieczą, która (miesza się / nie miesza się) z wodą i z innymi rozpuszczalnikami polarnymi, a z rozpuszczalnikami niepolarnymi, np. z benzenem, może tworzyć (emulsje / zawiesiny). 2. Ponieważ atomom węgla i tlenu w cząsteczkach glicerolu można przypisać hybrydyzację sp3, cząsteczki glicerolu (są / nie są) płaskie.
Wskazanie liczby reszt alaniny i glicyny oraz możliwe sekwencje aminokwasów w peptydach. Zadanie 33. Arkusz CKE chemia maj 2012 rozszerzony (2 punkty)
W wyniku hydrolizy peptydu o wzorze sumarycznym C8H15O4N3 otrzymano mieszaninę alaniny o wzorze CH3CH(NH2)COOH i glicyny o wzorze CH2(NH2)COOH.
Ustal, z ilu reszt alaniny i z ilu reszt glicyny składał się badany peptyd. Posługując się trzyliterowymi symbolami aminokwasów (Ala i Gly), napisz wszystkie możliwe sekwencje badanego peptydu. Liczba reszt alaniny (Ala): Liczba reszt glicyny (Gly): Możliwe sekwencje peptydu:
Projektowanie doświadczenia wykazującego, że etanol ma bardzo słabe właściwości kwasowe. Zadanie 34ab. Arkusz CKE chemia maj 2012 rozszerzony (2 punkty)
Etanol w reakcji z sodem wykazuje właściwości kwasowe. W wyniku tej reakcji powstaje etanolan sodu o wzorze C2H4O–Na+, który jest związkiem o charakterze soli.
Mając do dyspozycji etanolan sodu, zaplanuj doświadczenie, w którym, wykonując jedną próbę, wykażesz, że etanol ma bardzo słabe właściwości kwasowe. a) Uzupełnij poniższy schemat doświadczenia, wpisując nazwy potrzebnych odczynników wybranych spośród następujących: b) Opisz możliwe do zaobserwowania w czasie doświadczenia zmiany potwierdzające fakt, że właściwości kwasowe etanolu są bardzo słabe.
- etanol
- woda destylowana
- wodny roztwór wodorotlenku sodu
- wodny roztwór oranżu metylowego
- etanolowy roztwór fenoloftaleiny
Uzupełnienie schematu reakcji otrzymywania biopaliwa. Zadanie 35. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Paliwa do silników wysokoprężnych wytwarzane z ropy naftowej można zastąpić biopaliwami, które otrzymuje się, ogrzewając w obecności katalizatora oleje roślinne z dużą ilością alkoholu. Produktami tej reakcji są glicerol oraz ester kwasu tłuszczowego i użytego alkoholu. Proces ten można zilustrować ogólnym równaniem, w którym R1 i R2 oznaczają grupy węglowodorowe:
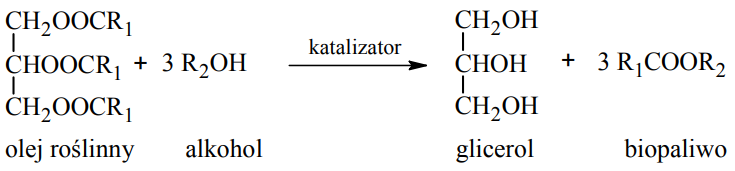
Na podstawie: G. W. vanLoon, S. J. Duffy, Chemia środowiska, Warszawa 2008
Uzupełnij luki w poniższym schemacie, tak aby stanowił on równanie reakcji ilustrujące otrzymywanie biopaliwa z trioleinianu glicerolu.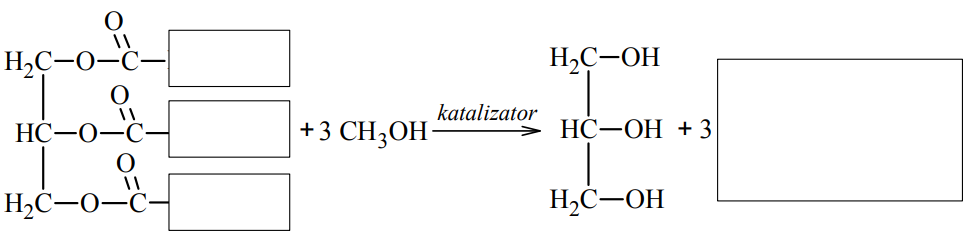
Wskazanie nazwy oddziaływań narysowanych na schemacie fragmentu cząsteczki kewlaru. Zadanie 36. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Kewlar to handlowa nazwa poli(tereftalano-1,4-fenyloamidu). Tworzywo to jest około pięciu razy wytrzymalsze od stali, a zarazem około pięciu razy od niej lżejsze. Swoje właściwości kewlar zawdzięcza wysokiemu stopniowi uporządkowania cząsteczek. Ułożenie łańcuchów polimerowych kewlaru przedstawiono na poniższym schemacie.
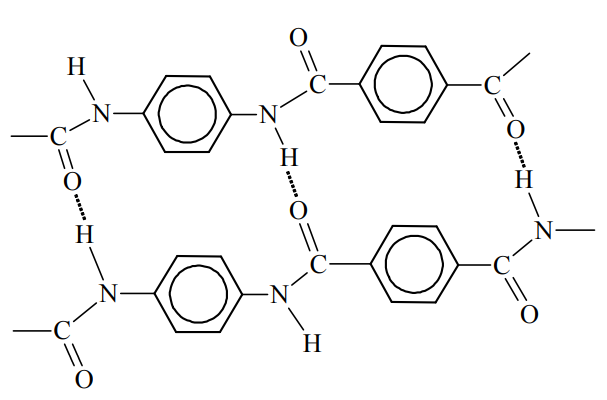
Podaj nazwę zaznaczonych na schemacie kropkami oddziaływań między atomami dwóch sąsiednich łańcuchów poli(tereftalano-1,4-fenyloamidu).
Uzupełnienie schematu reakcji syntezy kewlaru. Zadanie 37. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Kewlar to handlowa nazwa poli(tereftalano-1,4-fenyloamidu). Tworzywo to jest około pięciu razy wytrzymalsze od stali, a zarazem około pięciu razy od niej lżejsze. Swoje właściwości kewlar zawdzięcza wysokiemu stopniowi uporządkowania cząsteczek. Ułożenie łańcuchów polimerowych kewlaru przedstawiono na poniższym schemacie.

Kewlar otrzymuje się w reakcji polikondensacji dwóch rodzajów monomerów, z których jednym jest chlorek kwasu 1,4-benzenodikarboksylowego (tereftalowego).
Uzupełnij poniższy schemat syntezy kewlaru, wpisując wzór brakującego monomeru.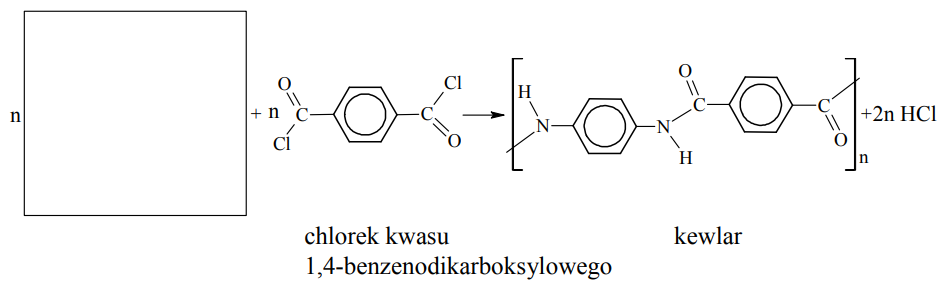
Przypisanie kewlaru do odpowiedniej grupy tworzyw sztucznych. Zadanie 38. Arkusz CKE chemia maj 2012 rozszerzony (1 punkt)
Kewlar to handlowa nazwa poli(tereftalano-1,4-fenyloamidu). Tworzywo to jest około pięciu razy wytrzymalsze od stali, a zarazem około pięciu razy od niej lżejsze. Swoje właściwości kewlar zawdzięcza wysokiemu stopniowi uporządkowania cząsteczek. Ułożenie łańcuchów polimerowych kewlaru przedstawiono na poniższym schemacie.

Zakwalifikuj kewlar do odpowiedniej grupy tworzyw. Podkreśl odpowiedź A, B, C lub D. A. poliamidy B. poliestry C. tworzywa fenolowe D. żywice epoksydowe