Te zadania pojawiły się na maturze (alkohole i fenole)
2023:
2022:
2021:
Zadanie 25.1, Zadanie 25.2, Zadanie 26.1, Zadanie 27
2020:
2019:
Zadanie 22, Zadanie 25, Zadanie 29, Zadanie 30
2018:
Zadanie 8.1, Zadanie 8.2, Zadanie 8.3, Zadanie 30.3, Zadanie 31, Zadanie 32
2017:
Zadanie 27.2, Zadanie 28, Zadanie 29.1, Zadanie 29.2
2016:
Zadanie 25.1, Zadanie 25.2, Zadanie 28
2015:
Ustalanie wzorów sumarycznych alkoholi należących do szeregu homologicznego metanolu
Stosunek mas molowych dwóch homologów metanolu wynosi 1,7.
Ustal wzory sumaryczne obu alkoholi, jeśli wiadomo, że cząsteczki cięższego z nich mają dwukrotnie więcej atomów węgla, niż cząsteczki lżejszego alkoholu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ustalanie wzoru półstrukturalnego oraz nazwy systematycznej II-rzędowego alkoholu
Na temat struktury cząsteczki pewnego monohydroksylowego, II-rzędowego alkoholu alifatycznego wiadomo, że zawiera między innymi trzy atomy węgla leżące na tej samej płaszczyźnie, ale nie wzdłuż tej samej linii. Na spalenie próbki tego alkoholu o masie 1,44 g zużywa się 1568 cm3 tlenu (warunki normalne), przy czym produktami opisanej reakcji chemicznej są tlenek węgla(II) oraz woda.
Narysuj wzór półstrukturalny (grupowy) cząsteczki tego alkoholu i podaj jego nazwę systematyczną. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie nazw alkoholi reagujących z wapniem według określonej stechiometrii
Pewne nasycone, izomeryczne alkohole łańcuchowe reagują z wapniem w stosunku wagowym równym (odpowiednio) 3:1, natomiast z sodem w stosunku molowym 1:1.
Wykonaj stosowne obliczenia, a następnie podaj nazwy systematyczne wszystkich alkoholi spełniających podane w informacji wprowadzającej warunki. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równań reakcji chemicznych na podstawie przeprowadzonego eksperymentu z udziałem alkoholi
Pewne nasycone, izomeryczne alkohole łańcuchowe reagują z wapniem w stosunku wagowym równym (odpowiednio) 3:1, natomiast z sodem w stosunku molowym 1:1.
W wyniku dwuetapowego procesu, pierwszorzędowy spośród opisanych w informacji wstępnej alkoholi można przekształcić w jego izomer o wyższej rzędowości. W jednym z etapów stosuje się wówczas między innymi rozcieńczony roztwór kwasu siarkowego(VI).
Napisz równania reakcji chemicznych przebiegających podczas każdego z etapów opisanego procesu. W tym celu zastosuj odpowiednie warunki ich prowadzenia oraz wzory półstrukturalne (grupowe) biorących w nich udział związków organicznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyjaśnienie przyczyny różnego zachowania się dwóch dioli wobec świeżo strąconego osadu wodorotlenku miedzi(II)
Pewne nasycone, izomeryczne alkohole łańcuchowe reagują z wapniem w stosunku wagowym równym (odpowiednio) 3:1, natomiast z sodem w stosunku molowym 1:1.
Istnieją pewne diole, których szkielety węglowe są takie same, jak opisanych izomerów reagujących z wapniem. Pierwszy z nich roztwarza świeżo strącony osad wodorotlenku miedzi(II) tworząc z nim barwny kompleks, a pozostałe nie.
Podaj nazwy systematyczne opisanych dioli oraz wyjaśnij opisane różnice w zachowaniu tych związków chemicznych wobec świeżo strąconego osadu wodorotlenku miedzi(II). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rysowanie wzoru stereochemicznego określonego alkoholu (izomeria optyczna)
Pewne nasycone, izomeryczne alkohole łańcuchowe reagują z wapniem w stosunku wagowym równym (odpowiednio) 3:1, natomiast z sodem w stosunku molowym 1:1.
Istnieją pewne diole, których szkielety węglowe są takie same, jak opisanych izomerów reagujących z wapniem. Jeden z opisanych dioli wykazuje czynność optyczną.
Uzupełnij poniższy schemat tak, aby przedstawiał parę enancjomerów tego diolu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyjaśnienie dużej różnicy w temperaturach wrzenia alkoholu oraz izomerycznego z nim nadtlenku organicznego
W wodnym 10,3-procentowym roztworze pewnego nasyconego alkoholu na jedną jego cząsteczkę przypada trzydzieści cząsteczek wody. Związek ten roztwarza świeżo strącony osad wodorotlenku miedzi(II) z utworzeniem szafirowego klarownego roztworu. Temperatura wrzenia opisanego alkoholu pod ciśnieniem normalnym wynosi 470 K. Przy identycznej wartości ciśnienia, jeden z jego izomerów wrze w temperaturze 287 K i należy do szeregu homologicznego tzw. nadtlenków organicznych, czyli związków chemicznych o wzorze ogólnym w postaci R1–O–O–R2. We wzorze tym R1 oraz R2 stanowią reszty cząsteczek tego samego, bądź różnych węglowodorów.
Na podstawie: www.pubchem.com oraz W. Mizerski, Tablice chemiczne, Warszawa 2013.
Wyjaśnij, czym spowodowana jest tak duża różnica w wartościach temperatur wrzenia wymienionych izomerycznych związków chemicznych? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór trwalszego spośród dwóch izomerycznych alkoholi zawierających cztery atomy węgla w cząsteczce
Trwałość alkoholi polihydroksylowych zależy od liczby grup –OH połączonych z tym samym atomem węgla w cząsteczce. Najtrwalsze są te alkohole, w cząsteczkach których dany atom węgla połączony jest z maksymalnie jedną grupą hydroksylową.
Rysunek poniżej przedstawia wzory grupowe dwóch wybranych izomerycznych związków chemicznych oznaczonych umownie literami A oraz B.
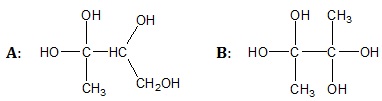
Podaj oznaczenie literowe (A lub B) trwalszego spośród wymienionych związków chemicznych oraz napisz jego nazwę systematyczną. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wzoru rzeczywistego oraz półstrukturalnego najtrwalszego izomeru alkoholu na podstawie znajomości stężeń jego roztworu
Trwałość alkoholi polihydroksylowych zależy od liczby grup –OH połączonych z tym samym atomem węgla w cząsteczce. Najtrwalsze są te alkohole, w cząsteczkach których dany atom węgla połączony jest z maksymalnie jedną grupą hydroksylową.
Pewien związek chemiczny zawierający jedynie hydroksylowe grupy funkcyjne tworzy 7,5-molowy wodny roztwór o gęstości 1,15 g∙cm–3 i stężeniu procentowym równym 60%. W jego cząsteczkach stosunek liczby atomów węgla do liczby atomów tlenu równy jest 1.
Wykonaj niezbędne obliczenia, a następnie narysuj wzór półstrukturalny oraz podaj nazwę systematyczną opisanego alkoholu, wiedząc, że jest on najtrwalszym spośród jego izomerów. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
