Roztwory buforowe są układami złożonymi:
– ze słabego kwasu (HA) i jego soli (anion A–) pochodzącej od mocnej zasady, przy czym przyjmuje się, że stężenie jonu A– jest wówczas równe stężeniu soli,
– ze słabej zasady (B) i jej soli (kation BH+) pochodzącej od mocnego kwasu, przy czym przyjmuje się, że stężenie jonu BH+ jest wówczas równe stężeniu soli.
Dla opisanych układów buforowych istnieją zależności:
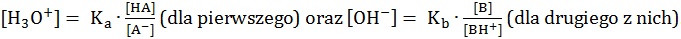
Rola bufora sprowadza się do utrzymania względnie stałego pH roztworu.
Na podstawie: P. W. Atkins, Chemia fizyczna, Warszawa 2012.
Do układów buforujących wchodzących w skład ludzkiej krwi należy bufor węglanowy. Jego składnikami są jony wodorowęglanowe oraz rozpuszczony w osoczu tlenek węgla(IV). Gdy podczas ciężkiego wysiłku fizycznego w mięśniach produkowany jest kwas mlekowy (Ka = 1,35·10–4), nadmiar jednego spośród dwóch rodzajów jonów pochodzących z jego dysocjacji zostaje zneutralizowany przez opisany bufor, natomiast powstający tlenek węgla(IV) usuwany jest z organizmu przez układ oddechowy.
a) Napisz w formie jonowej skróconej równanie opisanej reakcji buforu węglanowego.
b) Podkreśl wyrażenia w nawiasach tak, aby powstały zdania prawdziwe.
Bufor węglanowy neutralizuje jony (mleczanowe/wodorowe), dzięki czemu wartość pH (obniża się/podnosi się). Przebieg takiej reakcji jest możliwy, ponieważ wchodzący w skład buforu anion (węglanowy/wodorowęglanowy) jest kwasem Brønsteda (słabszym/silniejszym) niż kwas mlekowy.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone