Kwas azotowy(III) jest związkiem trwałym jedynie w bardzo rozcieńczonych roztworach. Dlatego, jeśli wprowadzi się stężony kwas siarkowy(VI) do wodnego roztworu azotanu(III) potasu o dostatecznie wysokim stężeniu, wówczas kwas azotowy(III) praktycznie nie powstanie. Obserwuje się wtedy wydzielanie bezbarwnego, bezwonnego gazu, który brunatnieje u wylotu naczynia reakcyjnego. Drugim produktem opisanej przemiany chemicznej jest woda, a kolejnym – kwas, w cząsteczkach którego azot przyjmuje maksymalny stopień utlenienia. Bezwodnikiem kwasu azotowego(III) jest nietrwały tlenek N2O3, który rozkłada się z utworzeniem dwóch opisanych wcześniej substancji gazowych. Po osiągnięciu stanu równowagi w temperaturze pokojowej T, faza gazowa może zawierać wtedy 50% objętościowych związku N2O3.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Słabym, wielohydronowym kwasem jest kwas ortofosforowy(V). Stałe równowagi kolejnych etapów jego dysocjacji elektrolitycznej w temperaturze 25 oC mają następujące wartości:
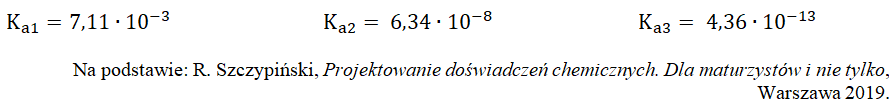
W teorii protonowej kwasów i zasad Brønsteda-Lowry’ego, z kwasu powstaje sprzężona z nim zasada, przy czym im mocniejszy jest kwas Brønsteda, tym słabsza sprzężona z nim zasada.
Po zmieszaniu jednakowych objętości rozcieńczonych roztworów o takim samym stężeniu molowym – azotanu(III) potasu oraz kwasu ortofosforowego(V) przebiega reakcja chemiczna:
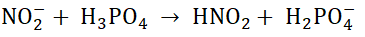
Napisz wzory sumaryczne sprzężonych par kwas-zasada Brønsteda biorących udział w opisanej reakcji chemicznej, biegnącej po zmieszaniu roztworów – azotanu(III) potasu oraz kwasu ortofosforowego(V). Uzupełnij tabelę.

© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone