Roztwory buforowe są układami zdolnymi do utrzymywania względnie stałego pH środowiska, a ich składowymi są sprzężone pary kwas-zasada Brønsteda. W zależności od rodzaju buforu, jego komponentami mogą być słaba zasada i jej sól z mocnym kwasem, albo słaby kwas i jego sól z mocną zasadą. Gdy do roztworu zawierającego bufor wprowadzi się kwas, wówczas pochodzące z jego dysocjacji jony wodorowe zostaną zneutralizowane w wyniku ich reakcji z zasadą Brønsteda stanowiącą składową buforu. Z kolei, wprowadzając do roztworu pewną liczbę jonów wodorotlenkowych, pochodzących z dysocjacji mocnej zasady, wówczas przereagują one z obecnym w układzie składnikiem buforu jakim jest kwas Brønsteda.
Przykładem układu buforującego stosowanego podczas prac z materiałem biologicznym jest tzw. bufor TRIS, a jego składnikami (oprócz wody destylowanej) są dwa związki chemiczne:

W roztworze tego buforu stężenie jonów wodorotlenkowych opisuje zależność:
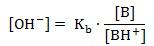
Wielkość [B] jest stężeniem molowym stanowiącej składnik buforu zasady Brønsteda, natomiast [BH+] to stężenie molowe stanowiącej jej pochodną soli. W temperaturze 25 oC aminoalkohol jest dobrze rozpuszczalnym w wodzie ciałem stałym, a stała równowagi reakcji jego dysocjacji Kb ma wartość 1,2∙10-6.
Na podstawie: P. W. Atkins, Chemia fizyczna, Warszawa 2012, R. Szczypiński, Zbiór zadań maturalnych z odpowiedziami. Zakres rozszerzony, Warszawa 2017 oraz www.sigmaaldrich.com.
Przygotowano 500 cm3 roztworu aminoalkoholu o stężeniu molowym równym 0,08 mol∙dm-3. Do podanego roztworu aminoalkoholu wprowadzono 672 cm3 chlorowodoru odmierzonego w temperaturze 273 K pod ciśnieniem 1013 hPa. Powstały roztwór rozcieńczono wodą destylowaną do objętości 1 dm3.
Oblicz wartość pH uzyskanego w ten sposób buforu TRIS. Wynik podaj z dokładnością do dwóch cyfr znaczących. Pomiń zjawisko autodysocjacji wody.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone