Heksafluorek siarki (SF6) jest bezbarwnym, bezwonnym, praktycznie nierozpuszczalnym w wodzie związkiem chemicznym, który w warunkach normalnych ma gazowy stan skupienia. Jego dawka śmiertelna nie została określona, jednak z uwagi na wysoką gęstość kumuluje się w płucach, co w sposób znaczący utrudnia wymianę gazową. Z uwagi na własności gaszące łuk elektryczny powszechnie stosowany jest w stacjach transformatorowych – w wyłącznikach prądu wysokonapięciowego. Rysunek poniżej ilustruje skład mieszaniny uzyskanej w wyniku rozkładu heksafluorku siarki w zależności od temperatury łuku elektrycznego pod ciśnieniem 0,6 MPa. Udział każdego ze składników mieszaniny poreakcyjnej wyrażono ułamkiem molowym, który definiuje się jako stosunek liczby moli tego składnika do sumarycznej liczby moli wszystkich składników mieszaniny.
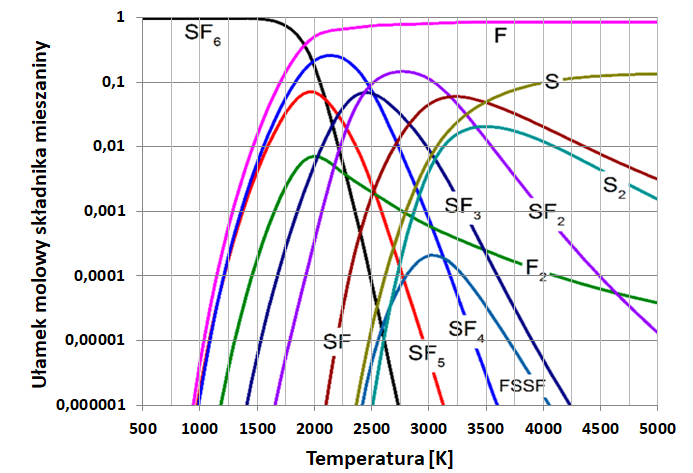
Na podstawie: R. Yang i inni, Decomposition characteristics of SF6 under arc discharge and the effects of trace H2O, O2, and PTFE vapour on its by-products, Xi’an 2021 oraz W. Mizerski, Tablice chemiczne, Warszawa 2013.
Zamieszczony rysunek ilustruje model cząsteczki heksafluorku siarki.
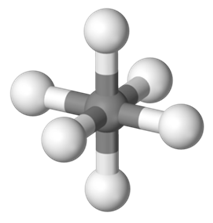
Związek ten ulega rozkładowi dopiero w temperaturze łuku elektrycznego. Powstałe wówczas cząsteczki jednego z produktów jego rozkładu mają kształt kątowy.
Oceń poprawność poniższych zdań dotyczących heksafluorku siarki oraz opisanego produktu jego rozkładu. Wpisz literę „P” (prawda) lub literę „F” (fałsz).
1. Zarówno cząsteczki heksafluorku siarki jak i produktu jego rozkładu mają budowę polarną.
2. W cząsteczce opisanego produktu rozkładu SF6 każdy z atomów uzyskuje oktet elektronowy.
3. Pod ciśnieniem 0,6 MPa opisany produkt rozkładu SF6 osiąga maksymalne stężenie w temperaturze, w której ułamek molowy substratu reakcji wynosi 10–4.
© dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone