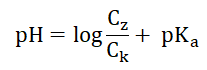Obliczanie wartości pH miareczkowanego roztworu wodorotlenku baru w określonym momencie miareczkowania (miareczkowanie)
Punktem równoważnikowym miareczkowania określa się moment, w którym analit przereagował ilościowo z dodanym z biurety titrantem. Roztwór wodorotlenku baru o objętości równej 50 cm3 miareczkowano 0,35-molowym roztworem kwasu solnego wobec błękitu bromotymolowego jako wskaźnika. Punkt równoważnikowy osiągnięto w momencie wykorzystania dokładnie 40 cm3 roztworu titranta.
Jaka była wartość pH miareczkowanego roztworu w momencie zobojętnienia połowy początkowej liczby jonów wodorotlenkowych, pochodzących z dysocjacji elektrolitycznej zasady barowej? Wynik podaj z dokładnością do dwóch cyfr znaczących. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego oraz pH zmiareczkowanego roztworu (miareczkowanie)
Do 27 g wody destylowanej dodano 6 g tlenku potasu i uzupełniono wodą do objętości 150 cm3. Z uzyskanego w ten sposób roztworu pobrano 20 cm3 próbki za pomocą której zobojętniono 40 cm3 roztworu kwasu siarkowego(VI).
Oblicz, jakie było stężenie molowe zmiareczkowanego roztworu kwasu oraz jego pH? Przyjmij, że powstały w pierwszym etapie dysocjacji anion wodorosiarczanowy(VI) dysocjuje całkowicie. Wyniki obliczeń podaj z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie wartości pH zmiareczkowanego roztworu wodorotlenku baru (miareczkowanie)
Punktem równoważnikowym miareczkowania określa się moment, w którym analit przereagował ilościowo z dodanym z biurety titrantem. Roztwór wodorotlenku baru o objętości równej 50 cm3 miareczkowano 0,35-molowym roztworem kwasu solnego wobec błękitu bromotymolowego jako wskaźnika. Punkt równoważnikowy osiągnięto w momencie wykorzystania dokładnie 40 cm3 roztworu titranta.
Ustal wartość pH miareczkowanego roztworu wodorotlenku baru. Wynik obliczeń podaj z dokładnością do pierwszego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie pH roztworu titranta (miareczkowanie)
Do 27 g wody destylowanej dodano 6 g tlenku potasu i uzupełniono wodą do objętości 150 cm3. Z uzyskanego w ten sposób roztworu pobrano 20 cm3 próbki za pomocą której zobojętniono 40 cm3 roztworu kwasu siarkowego(VI).
Oblicz, jakie było pH roztworu wykorzystanego do zmiareczkowania roztworu kwasu siarkowego(VI)? Wynik podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie barwy roztworu w punkcie równoważnikowym miareczkowania, przy określonej wartości pH (miareczkowanie)
Punktem równoważnikowym miareczkowania określa się moment, w którym analit przereagował ilościowo z dodanym z biurety titrantem. Roztwór wodorotlenku baru o objętości równej 50 cm3 miareczkowano 0,35-molowym roztworem kwasu solnego wobec błękitu bromotymolowego jako wskaźnika. Punkt równoważnikowy osiągnięto w momencie wykorzystania dokładnie 40 cm3 roztworu titranta.
W zakresie pH 6,2÷7,6 roztwory zawierające błękit bromotymolowy mają kolor zielony. Określ, czy w punkcie równoważnikowym miareczkowany roztwór przyjął podane zabarwienie? Odpowiedź uzasadnij jednym zdaniem. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania procesu zachodzącego w buforze amonowym po dodaniu roztworu wodorotlenku potasu ze wskazaniem sprzężonych par kwas-zasada (bufory)
Roztwory buforowe są układami zdolnymi do utrzymywania względnie stałego pH środowiska, a ich składowymi są sprzężone pary kwas-zasada Brønsteda. Gdy do roztworu zawierającego bufor wprowadzi się kwas, wówczas pochodzące z jego dysocjacji jony wodorowe zostaną zneutralizowane w wyniku ich reakcji z zasadą Brønsteda stanowiącą składową buforu. Z kolei, wprowadzając do roztworu pewną liczbę jonów wodorotlenkowych, pochodzących z dysocjacji mocnej zasady, wówczas przereagują one z obecnym w układzie składnikiem buforu jakim jest kwas Brønsteda.
Przykładem buforu jest roztwór stanowiący mieszaninę wody amoniakalnej z chlorkiem amonu.
Napisz w formie jonowej skróconej równanie procesu, jaki przebiegnie po wprowadzeniu do takiego układu buforującego kilku kropli roztworu wodorotlenku potasu. W zapisanym równaniu wskaż sprzężone pary kwas-zasada Brønsteda. Równanie procesu: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równań procesów zachodzących w buforze fosforanowym po wprowadzeniu do niego roztworu kwasu oraz roztworu zasady (bufory)
Roztwory buforowe można uzyskać również po rozpuszczeniu w wodzie dwóch wodorosoli. Przykładem takiego układu jest bufor fosforanowy, w którym rolę kwasu Brønsteda pełni ten wodoroanion, którego stała równowagi dysocjacji kwasowej jest większa.
Uzupełnij poniższy schemat wzorami odpowiednich drobin, aby zilustrować równaniami jonowymi działanie buforu fosforanowego po wprowadzeniu do niego roztworu kwasu oraz roztworu zasady. Przyjmij, że stosunek molowy reagentów jest równy jedności. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wskazanie pary związków chemicznych, których wodne roztwory po zmieszaniu utworzą roztwór buforowy (bufory)
Roztwory buforowe są układami złożonymi:
– ze słabego kwasu (HA) i jego soli (anion A–) pochodzącej od mocnej zasady, przy czym przyjmuje się, że stężenie jonu A– jest wówczas równe stężeniu soli,
– ze słabej zasady (B) i jej soli (kation BH+) pochodzącej od mocnego kwasu, przy czym przyjmuje się, że stężenie jonu BH+ jest wówczas równe stężeniu soli.
Dla opisanych układów buforowych istnieją zależności:
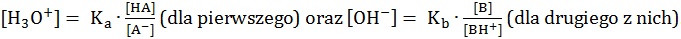
Rola bufora sprowadza się do utrzymania względnie stałego pH roztworu.
Na podstawie: P. W. Atkins, Chemia fizyczna, Warszawa 2012.
Poniżej znajdują się ułożone parami, wodne roztwory wybranych związków chemicznych.
Podkreśl tę parę, której roztwory po zmieszaniu ze sobą w odpowiednich proporcjach utworzą roztwór buforowy i wskaż w powstałym układzie kwas oraz sprzężoną z nim zasadę Brønsteda. 1) CH3COOH oraz KOH 2) NH4Br oraz HBr 3) KCl oraz HCl © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie masy soli niezbędnej do przygotowania roztworu buforu amonowego o określonej wartości pH (bufory)
Roztwory buforowe są układami złożonymi:
– ze słabego kwasu (HA) i jego soli (anion A–) pochodzącej od mocnej zasady, przy czym przyjmuje się, że stężenie jonu A– jest wówczas równe stężeniu soli,
– ze słabej zasady (B) i jej soli (kation BH+) pochodzącej od mocnego kwasu, przy czym przyjmuje się, że stężenie jonu BH+ jest wówczas równe stężeniu soli.
Dla opisanych układów buforowych istnieją zależności:
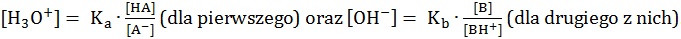
Rola bufora sprowadza się do utrzymania względnie stałego pH roztworu.
Na podstawie: P. W. Atkins, Chemia fizyczna, Warszawa 2012.
W kolbie miarowej o pojemności 1 dm3 umieszczono 500 cm3 20% roztworu wody amoniakalnej o gęstości 0,92 g/cm3.
Jaką ilość chlorku amonu należy odważyć do kolby, aby po uzupełnieniu wodą destylowaną „do kreski” uzyskać bufor amonowy o pH = 11? Wynik obliczeń podaj z dokładnością do trzech cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia roztworu kwasu octowego do przygotowania roztworu buforu octanowego o określonej wartości pH (bufory)
Roztwory buforowe są układami złożonymi:
– ze słabego kwasu (HA) i jego soli (anion A–) pochodzącej od mocnej zasady, przy czym przyjmuje się, że stężenie jonu A– jest wówczas równe stężeniu soli,
– ze słabej zasady (B) i jej soli (kation BH+) pochodzącej od mocnego kwasu, przy czym przyjmuje się, że stężenie jonu BH+ jest wówczas równe stężeniu soli.
Dla opisanych układów buforowych istnieją zależności:
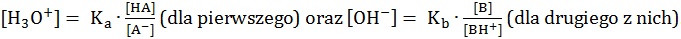
Rola bufora sprowadza się do utrzymania względnie stałego pH roztworu.
Na podstawie: P. W. Atkins, Chemia fizyczna, Warszawa 2012.
W kolbie miarowej o pojemności 250 cm3 umieszczono 4,1 g octanu sodu.
Oblicz, jakie powinno być stężenie molowe roztworu kwasu octowego, aby po napełnieniu nim kolby „do kreski”, pH uzyskanego w ten sposób buforu octanowego było równe 4,5? Wynik podaj z dokładnością do dwóch cyfr znaczących. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie odczynu roztworu wodnego wraz z uzasadnieniem wyboru właściwej substancji (hydroliza soli)
W tabeli poniżej zgromadzono dane na temat roztworów wodnych czterech związków chemicznych.

W jednym z wymienionych w tabeli roztworów za odczyn odpowiada proces inny, niż dysocjacja elektrolityczna. Podaj nazwę tego procesu oraz napisz, jaki odczyn ma znajdujący się w opisanym naczyniu roztwór? Odpowiedź uzasadnij równaniem chemicznym zapisanym w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone