Bilansowanie równania reakcji redoks z udziałem siarkowodoru oraz zakwaszonego roztworu dwuchromianu(VI) potasu
Przeprowadzono doświadczenie, którego schemat ilustruje rysunek poniżej. Podczas przebiegu tego eksperymentu zastosowano nadmiar kwasu siarkowego(VI) oraz zaobserwowano między innymi wytrącenie się żółtego osadu, który w wyniku spalenia w tlenie daje gazowy produkt o drażniącej woni. Związek ten powoduje odbarwienie zakwaszonego roztworu manganianu(VII) potasu. Zastosowane ilości siarkowodoru oraz dwuchromianu(VI) potasu były względem siebie w stosunku stechiometrycznym, a reakcja w płuczce przebiegła ze 100% wydajnością. Zebrany w cylindrze gaz X zajął objętość równą 647 cm3 (w przeliczeniu na warunki normalne).
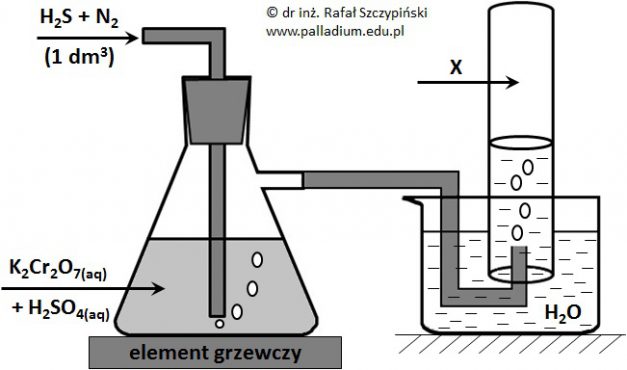
Napisz w formie jonowej skróconej równanie reakcji jaka przebiegła w płuczce. Współczynniki stechiometryczne uzgodnij metodą bilansu jonowo-elektronowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Przemiana jonów zawierających chrom w aniony chromianowe(VI) bez zmiany stopni utlenienia pierwiastków
Anion chromianowy(VI) może powstać również w reakcji, podczas przebiegu której pierwiastki nie zmieniają swych stopni utlenienia. Substratem jest wówczas związek chemiczny chromu, którego aniony obecne w wodnym roztworze nadają mu pomarańczowe zabarwienie.
Napisz w formie jonowej skróconej równanie opisanej przemiany. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Bilansowanie równania reakcji utleniania jonu azotanowego(III) nadtlenkiem wodoru
W probówce umieszczono wodny roztwór azotanu(III) sodu z dodatkiem kilku kropli alkoholowego roztworu fenoloftaleiny. Do układu wprowadzono następnie stechiometryczną ilość wody utlenionej i zaobserwowano zmianę świadczącą o przebiegu reakcji chemicznej.
Napisz w formie jonowej skróconej równanie reakcji chemicznej jaka przebiegła w probówce po dodaniu wody utlenionej do jej zawartości. Współczynniki uzgodnij metodą bilansu jonowo-elektronowego, uwzględniając odczyn znajdującego się w naczyniu przed rozpoczęciem reakcji wodnego roztworu soli. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór poprawnych określeń dotyczących doświadczenia z udziałem nadtlenku wodoru oraz azotanu(III) sodu
W probówce umieszczono wodny roztwór azotanu(III) sodu z dodatkiem kilku kropli alkoholowego roztworu fenoloftaleiny. Do układu wprowadzono następnie stechiometryczną ilość wody utlenionej i zaobserwowano zmianę świadczącą o przebiegu reakcji chemicznej.
Podkreśl wyrażenia w nawiasach tak, aby powstały zdania prawdziwe. Wodny roztwór azotanu(III) sodu miał odczyn (kwasowy/obojętny/zasadowy). Rolę reduktora w opisanym procesie redoks pełniły wówczas jony (OH–/NO2–), natomiast utleniaczem były cząsteczki (H2O2/H2O). W wyniku przebiegu reakcji chemicznej roztwór (zabarwił się/odbarwił się), co pozwala wnioskować, że wartość jego pH uległa (zwiększeniu/zmniejszeniu). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji roztwarzania miedzi w roztworze zawierającym jony żelaza(III)
Metaliczna miedź może zostać roztworzona za pomocą wodnych roztworów niektórych związków chemicznych. Jeśli do przeprowadzenia opisanego procesu wykorzysta się roztwór chlorku żelaza(III), w układzie pojawiają się wówczas dwa rodzaje kationów. Elektrony opisane orbitalami d jednego z nich stanowią 2/3 liczby elektronów opisanych orbitalami d drugiego z powstałych jonów.
Napisz w formie jonowej skróconej równanie opisanej reakcji chemicznej oraz określ, jaką barwę przyjmie roztwór po jej zakończeniu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone