Te zadania pojawiły się na maturze (reakcje redoks, pierwiastki bloku d)
2025:
Zadanie 5.1, Zadanie 6, Zadanie 7.2
2024:
Zadanie 11, Zadanie 3.4, Zadanie 10
2023:
Zadanie 13.2, Zadanie 13.3, Zadanie 14, Zadanie 16, Zadanie 17, Zadanie 18
2022:
Zadanie 12.1, Zadanie 12.2, Zadanie 12.3, Zadanie 13
2021:
Zadanie 18.1, Zadanie 18.2, Zadanie 19.1, Zadanie 22
2020:
Zadanie 11, Zadanie 18.1, Zadanie 18.2, Zadanie 28
2019:
Zadanie 21, Zadanie 32, Zadanie 34, Zadanie 36.1, Zadanie 36.2
2018:
Zadanie 7, Zadanie 18.1, Zadanie 18.2, Zadanie 20, Zadanie 21, Zadanie 22
2017:
2016:
Zadanie 10.1, Zadanie 10.2, Zadanie 16.1, Zadanie 16.2, Zadanie 16.3, Zadanie 16.4, Zadanie 34, Zadanie 36, Zadanie 37
2015:
Zadanie 23.1, Zadanie 23.2, Zadanie 23.3
Obliczanie masy produktu uzyskanego w wyniku reakcji redoks z udziałem siarkowodoru oraz zakwaszonego roztworu dwuchromianu(VI) potasu
Przeprowadzono doświadczenie, którego schemat ilustruje rysunek poniżej. Podczas przebiegu tego eksperymentu zastosowano nadmiar kwasu siarkowego(VI) oraz zaobserwowano między innymi wytrącenie się żółtego osadu, który w wyniku spalenia w tlenie daje gazowy produkt o drażniącej woni. Związek ten powoduje odbarwienie zakwaszonego roztworu manganianu(VII) potasu. Zastosowane ilości siarkowodoru oraz dwuchromianu(VI) potasu były względem siebie w stosunku stechiometrycznym, a reakcja w płuczce przebiegła ze 100% wydajnością. Zebrany w cylindrze gaz X zajął objętość równą 647 cm3 (w przeliczeniu na warunki normalne).
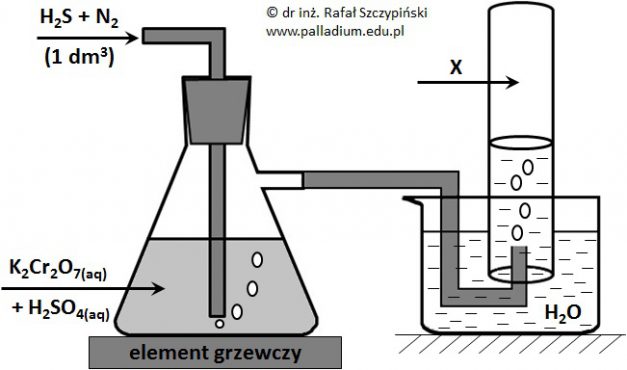
Oblicz masę żółtego osadu jaki wytrącił się w płuczce. Wynik podaj z dokładnością do pierwszego miejsca po przecinku. Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji tlenku srebra z wodnym roztworem nadtlenku wodoru
Tlenek srebra(I) reaguje z wodnym roztworem nadtlenku wodoru, w wyniku czego powstaje srebro oraz wydziela się bezbarwny, bezwonny, podtrzymujący palenie gaz.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Napisz równanie opisanej reakcji chemicznej oraz podaj wzór sumaryczny substancji pełniącej rolę utleniacza i wzór substancji będącej reduktorem. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis równania reakcji wymiany ligandu w jonie kompleksowym kobaltu zbudowanym z trzech rodzajów ligandów
Pierwiastki bloku d tworzą liczne związki kompleksowe, w których występują w postaci jonów kompleksowych. Ładunek takiego jonu zależy zarówno od ładunku kationu stanowiącego jon centralny oraz od rodzaju jego ligandów – cząsteczek lub jonów związanych z jonem centralnym wiązaniami koordynacyjnymi. Wartość liczby koordynacyjnej jonu centralnego dostarcza informacji na temat liczby ligandów związanych z tym jonem w obrębie kompleksu.
Ligandy w jonach kompleksowych mogą być wymieniane na inne ligandy. Na przykład znajdujący się w wodnym roztworze jon kompleksowy zbudowany z kationów kobaltu oraz trzech rodzajów ligandów ma wzór sumaryczny [CoCl(NH3)4(H2O)]2+. Drobina taka reaguje z wodą amoniakalną, co w efekcie prowadzi do wymiany cząsteczki wody na cząsteczkę amoniaku.
Napisz równanie opisanej przemiany chemicznej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór drobiny będącej wyłącznie reduktorem
Poniżej przedstawiono zbiór wybranych indywiduów chemicznych:
Br2, Cl–, O22–, MnO4–, H+, Fe, Cr2+, SO32–, S2–, H2O2, NO2–, H2, F2.
Spośród wymienionych wyżej drobin wybierz te, które w procesie redoks mogą pełnić wyłącznie rolę reduktora. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór drobiny o kształcie piramidy trygonalnej oraz reakcja redoks z jej udziałem
Poniżej przedstawiono zbiór wybranych indywiduów chemicznych:
Br2, Cl–, O22–, MnO4–, H+, Fe, Cr2+, SO32–, S2–, H2O2, NO2–, H2, F2.
Jedna spośród wymienionych drobin ma kształt piramidy trygonalnej. Do zakwaszonego roztworu dwuchromianu(VI) potasu dodano wodny roztwór soli potasowej zawierający drobinę o podanym wyżej kształcie. Zawartość naczynia ogrzano i zaobserwowano dwie zmiany świadczące o przebiegu reakcji chemicznej.
Podaj spodziewane obserwacje i napisz w formie jonowej skróconej równanie przebiegającej reakcji chemicznej. Współczynniki uzgodnij stosując metodę bilansu jonowo-elektronowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór drobiny pochodzącej od pierwiastka o określonej konfiguracji elektronowej oraz reakcja redoks z jej udziałem
Poniżej przedstawiono zbiór wybranych indywiduów chemicznych:
Br2, Cl–, O22–, MnO4–, H+, Fe, Cr2+, SO32–, S2–, H2O2, NO2–, H2, F2.
W skład jednego z podanych anionów wchodzi pierwiastek, którego atomy w stanie podstawowym mają konfigurację elektronów walencyjnych w postaci: 4s23d5. W reakcji z mocnym kwasem, sól zawierająca drugi z anionów daje brunatny gaz o drażniącej woni.
Napisz w formie jonowej skróconej równanie reakcji chemicznej przebiegającej w środowisku kwasowym między wybranymi przez Ciebie, opisanymi wyżej dwoma jonami. Zastosuj metodę bilansu jonowo-elektronowego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji oraz uzasadnienie równaniem reakcji chemicznej z udziałem chlorku potasu oraz zakwaszonego roztworu manganianu(VII) potasu
Pewien student przeprowadził doświadczenie zilustrowane poniższym rysunkiem:
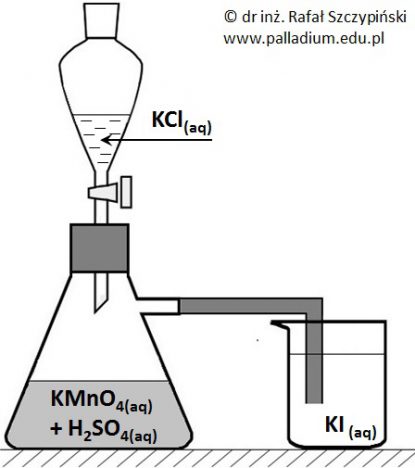
W celu wykonania tego eksperymentu zastosował stężone wodne roztwory soli oraz kwasu siarkowego(VI).
Napisz, co zaobserwowano w kolbie? Odpowiedź uzasadnij równaniem odpowiedniej reakcji chemicznej, zapisanym w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis barwy zawartości naczynia po wykonaniu doświadczenia z udziałem roztworu jodku potasu oraz uzasadnienie równaniem reakcji chemicznej
Pewien student przeprowadził doświadczenie zilustrowane poniższym rysunkiem:

W celu wykonania tego eksperymentu zastosował stężone wodne roztwory soli oraz kwasu siarkowego(VI). W trakcie doświadczenia obserwowano coraz to intensywniejsze zabarwienie znajdującego się w zlewce roztworu.
Napisz, jaką barwę przyjęła zawartość zlewki po zakończeniu doświadczenia? Odpowiedź uzasadnij równaniem przebiegającej reakcji chemicznej, zapisanym w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena poprawności sformułowanej tezy oraz uzasadnienie na podstawie przeprowadzonego eksperymentu
Pewien student przeprowadził doświadczenie zilustrowane poniższym rysunkiem:

W celu wykonania tego eksperymentu zastosował stężone wodne roztwory soli oraz kwasu siarkowego(VI).
Po zakończeniu doświadczenia, student sformułował dwa wnioski oraz jedną tezę.
Wniosek 1: anion manganianowy(VII) zdolny jest do utlenienia anionu chlorkowego.
Wniosek 2: chlor jest silniejszym utleniaczem od jodu.
Teza: anion manganianowy(VII) zdolny jest do utlenienia anionu jodkowego.
Czy teza postawiona przez studenta jest prawdziwa? Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone