Wybór odczynnika strącającego jony chlorkowe. Podręcznik 4.3 zad. 1. Metody rozdziału mieszanin
Analiza próbki wody przemysłowej o objętości 10 cm3 wykazała, że zawiera jony Fe2+, Mg2+, Ca2+ oraz aniony chlorkowe. Stężenia wszystkich kationów są jednakowe i wynoszą 0,002 mol∙dm–3.
Spośród wymienionych poniżej wodnych roztworów substancji, wybierz ten odczynnik, za pomocą którego z roztworu usunięte zostaną wyłącznie jony chlorkowe. Odpowiedź uzasadnij równaniem reakcji chemicznej, zapisanym w formie jonowej skróconej. Dostępne odczynniki w postaci roztworów wodnych: NaOH, ZnSO4, AgNO3, K3PO4. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Sporządzanie określonej masy nasyconego roztworu azotanu(V) srebra. Podręcznik 4.3 zad. 2
W temperaturze 293 K rozpuszczalność azotanu(V) srebra wynosi 210 g/100 g wody.
Wykonaj stosowne obliczenia, a następnie opisz niezbędne czynności, w celu przygotowania 50 g nasyconego w temperaturze 293 K wodnego roztworu azotanu(V) srebra. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie przybliżonej rozpuszczalności siarczanu(VI) potasu na podstawie reakcji strąceniowej. Podręcznik 4.3 zad. 3
Wyrażoną w g/100 g wody rozpuszczalność substancji można wyznaczyć pośrednio podczas pewnego doświadczenia chemicznego. Prowadzi się wówczas reakcję chemiczną, uzyskując osad praktycznie nierozpuszczalnego w wodzie związku chemicznego.
Do 50 g nasyconego w temperaturze 293 K roztworu K2SO4 wprowadzono taką ilość roztworu chlorku baru, że zawarta w nim substancja rozpuszczona była w nadmiarze, w stosunku do siarczanu(VI) potasu. Uzyskany osad przesączono, przemyto i wysuszono, a jego masa była równa 6,635 g.
Oblicz wyrażoną w g/100 g wody rozpuszczalność siarczanu(VI) potasu w temperaturze 293 K. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Sporządzanie roztworu kwasu siarkowego(VI) o określonym stężeniu procentowym metodą rozcieńczania stężonego roztworu kwasu. Podręcznik 4.3 zad. 4
Dysponujemy stężonym (96%) roztworem tego kwasu o gęstości 1,84 g·cm–3, wodą destylowaną oraz niezbędnym szkłem laboratoryjnym.
Wykonaj stosowne obliczenia, a następnie opisz niezbędne czynności, w celu przygotowania 230 g roztworu kwasu siarkowego(VI) o stężeniu 30%. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Sporządzanie roztworu kwasu siarkowego(VI) o określonym stężeniu molowym metodą rozcieńczania stężonego roztworu kwasu. Podręcznik 4.3 zad. 5
Dysponujemy stężonym (96%, d = 1,84 g/cm³) roztworem tego kwasu siarkowego(VI), wodą destylowaną oraz niezbędnym szkłem laboratoryjnym.
Wykonaj stosowne obliczenia, a następnie opisz niezbędne czynności, w celu przygotowania 500 cm³ roztworu kwasu siarkowego(VI) o stężeniu 2 mol∙dm–3. Zaniedbaj zjawisko kontrakcji. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Sporządzenie nasyconego roztworu octanu sodu z wykorzystaniem hydratu tej soli (hydraty). Podręcznik 4.3 zad. 6
Rozpuszczalność trójwodnego octanu sodu w temperaturze 20 ⁰C wynosi 111 g/100 g wody.
Wykonaj stosowne obliczenia i opisz niezbędne czynności, aby dysponując podanym hydratem sporządzić 500 g nasyconego w temperaturze 20 ⁰C wodnego roztworu soli. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Sporządzanie roztworu octanu sodu o określonym stężeniu procentowym wykorzystując hydrat tej soli (hydraty). Podręcznik 4.3 zad. 7
Rozpuszczalność trójwodnego octanu sodu w temperaturze 20 oC wynosi 111 g/100 g wody.
Wykonaj stosowne obliczenia, a następnie opisz niezbędne czynności, aby dysponując podanym hydratem octanu sodu oraz wodą destylowaną, w temperaturze 20 oC przygotować 200 g roztworu soli bezwodnej o stężeniu 10%. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Sporządzanie roztworu octanu sodu o określonym stężeniu molowym wykorzystując hydrat tej soli (hydraty). Podręcznik 4.3 zad. 8
Rozpuszczalność trójwodnego octanu sodu w temperaturze 20 ⁰C wynosi 111 g/100 g wody.
Wykonaj stosowne obliczenia i opisz niezbędne czynności, aby w temperaturze 20 ⁰C z podanego hydratu przygotować 250 cm3 0,1-molowego roztworu octanu sodu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Sporządzanie nasyconego roztworu glukozy poprzez obniżanie temperatury. Podręcznik 4.3 zad. 9
Nasycony w temperaturze 20 ⁰C roztwór glukozy zawiera 91 g cukru na każde 100 g wody, a w temperaturze 60 ⁰C jest to 277 g/100 g wody.
Wykonaj stosowne obliczenia, a następnie opisz czynności, jakie należy wykonać, aby wykorzystując jedynie szkło i aparaturę laboratoryjną, z 200 g nasyconego w temperaturze 60 ⁰C roztworu glukozy uzyskać nasycony w temperaturze 20 ⁰C roztwór tego monosacharydu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie, w którym roztworze uzyskano niższą wartość pH. Podręcznik 5.3 zad. 1
Przygotowano dwie zlewki z wodą destylowaną. Do pierwszej z nich wprowadzono po jednym molu tlenku siarki(IV) i amoniaku. Do drugiej zlewki również wprowadzono oba te gazy, ale ich stosunek molowy był równy odpowiednio 1:2.
Uzasadnij równaniem odpowiedniej reakcji chemicznej, zapisanym w formie jonowej skróconej, w której ze zlewek uzyskano roztwór o niższej wartości pH? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Identyfikacja roztworu kwasu wskaźnikiem alkacymetrycznym na podstawie obliczonej wartości pH (miareczkowanie). Podręcznik Podręcznik 5.3 zad. 2
W tabeli zebrano informacje na temat wybranych wskaźników alkacymetrycznych.
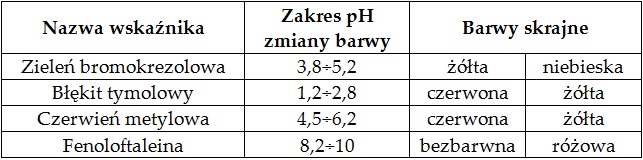
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
W dwóch różnych probówkach umieszczono po 3 cm3 wodnych roztworów kwasów, przy czym były to 0,5-molowy kwas chlorowy(III), a w drugiej kwas etanowy o stężeniu 0,01 mol∙dm–3.
Wykonaj stosowne obliczenia, a następnie dysponując jedynie wymienionymi wskaźnikami alkacymetrycznymi, zaprojektuj doświadczenie, którego celem będzie identyfikacja każdego z roztworów kwasów. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego powstałego roztworu octanu sodu w punkcie równoważnikowym miareczkowania (miareczkowanie). Podręcznik 5.3 zad. 3.1
W tabeli zebrano informacje na temat wybranych wskaźników alkacymetrycznych.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Miareczkowano wodny roztwór kwasu octowego wobec pewnego wskaźnika alkacymetrycznego, którego nazwę wymieniono w tabeli, w informacji wprowadzającej. Jako titrant zastosowano wodny roztwór wodorotlenku sodu. Punkt równoważnikowy miareczkowania osiągnięto przy wartości pH równej 8,9.
Oblicz stężenie molowe uzyskanego roztworu soli w punkcie równoważnikowym miareczkowania. Wynik podaj z dokładnością do jednego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór odpowiedniego wskaźnika kwasowo-zasadowego podczas miareczkowania roztworu kwasu octowego (miareczkowanie). Podręcznik 5.3 zad. 3.2
W tabeli zebrano informacje na temat wybranych wskaźników alkacymetrycznych.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Miareczkowano wodny roztwór kwasu octowego wobec pewnego wskaźnika alkacymetrycznego, którego nazwę wymieniono w tabeli, w informacji wprowadzającej. Jako titrant zastosowano wodny roztwór wodorotlenku sodu. Punkt równoważnikowy miareczkowania osiągnięto przy wartości pH równej 8,9.
Podaj nazwę wskaźnika alkacymetrycznego, jaki został wykorzystany podczas opisanego doświadczenia. Uzasadnij swój wybór. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie stężenia molowego powstałego roztworu bromku etyloamoniowego w punkcie równoważnikowym miareczkowania (miareczkowanie). Podręcznik 5.3 zad. 4.1
Miareczkowano wodny roztwór etyloaminy wobec czerwieni metylowej. Jako titrant zastosowano wodny roztwór kwasu bromowodorowego. Punkt równoważnikowy miareczkowania osiągnięto przy wartości pH równej 5,7.
Oblicz stężenie molowe uzyskanego roztworu soli w punkcie równoważnikowym miareczkowania. Wynik podaj z dokładnością do jednego miejsca po przecinku. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie przyczyny określonego odczynu wodnego roztworu bromku etyloamoniowego w punkcie równoważnikowym miareczkowania wraz z uzasadnieniem (miareczkowanie). Podręcznik 5.3 zad. 4.2
W tabeli zebrano informacje na temat wybranych wskaźników alkacymetrycznych.

Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 2013.
Miareczkowano wodny roztwór etyloaminy wobec czerwieni metylowej. Jako titrant zastosowano wodny roztwór kwasu bromowodorowego. Punkt równoważnikowy miareczkowania osiągnięto przy wartości pH równej 5,7.
Podaj nazwę procesu, którego przebieg warunkuje taki, a nie inny odczyn roztworu uzyskanego w punkcie równoważnikowym podczas tego doświadczenia. Odpowiedź uzasadnij równaniem odpowiedniej reakcji chemicznej, zapisanym w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone

