Przypisywanie określeń do właściwości chemicznych oraz fizycznych. Podręcznik 1.3 zad. 1
Każdej substancji chemicznej można przypisać określone właściwości fizyczne oraz chemiczne.
Przyporządkuj podane określenia do właściwości chemicznych oraz fizycznych. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
a) Gęstość substancji.
b) Odczyn kwasowy wodnego roztworu.
c) Stały stan skupienia.
d) Temperatura topnienia równa 0 oC.
e) Silny utleniacz.
f) Barwa ceglastoczerwona.
g) Wysoka lotność.
h) Łatwopalność.
Wybór ucznia, który dokonał właściwych obserwacji oraz sformułował poprawne wnioski. Podręcznik 1.3 zad. 3
Przeprowadzono doświadczenie chemiczne, podczas którego przebiegła reakcja opisana równaniem:
2KMnO4(s) → K2MnO4(s) + MnO2(s) + O2(g)
Trzej uczniowie w swoich zeszytach zanotowali następujące opisy obserwacji:
Uczeń A: wydzielił się bezbarwny gaz, którym jest tlen.
Uczeń B: wydzielił się bezbarwny, bezwonny gaz, a barwa fazy stałej uległa zmianie.
Uczeń C: manganian(VII) potasu uległ rozkładowi, ponieważ jest substancją nietrwałą w odpowiednio wysokiej temperaturze.
Tylko jeden z uczniów w sposób poprawny zanotował obserwacje zjawisk towarzyszących przebiegowi tego doświadczenia. Wskaż, który był to uczeń oraz podaj, jakie błędy popełnili pozostali? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Obliczanie szybkości reakcji chemicznej biegnącej w niższej temperaturze, reguła van't Hoffa. Podręcznik 2.2 zad. 1
Zależność szybkości reakcji chemicznej od temperatury z pewnym przybliżeniem opisuje tzw. reguła van’t Hoffa, którą przedstawia się wzorem:
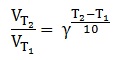
W wyrażeniu tym VT1 oraz VT2 to szybkości reakcji prowadzonych w temperaturach – bazowej (T1) oraz po jej zmianie (T2) – zwiększeniu, bądź zmniejszeniu. Parametr γ to tzw. współczynnik temperaturowy van’t Hoffa, który jest wielkością charakterystyczną dla danej reakcji chemicznej.
Współczynnik temperaturowy van’t Hoffa pewnej biegnącej zgodnie z kinetyką I-rzędu reakcji chemicznej ma wartość równą 2. Przy stężeniu substratu równym 1 mol∙dm–3 początkowa szybkość tej reakcji w temperaturze T1 wynosi 0,15 mol·dm–3·s–1.
Oblicz, jaka byłaby szybkość początkowa tej reakcji, gdyby przeprowadzono ją w temperaturze T2 niższej o 20 K od temperatury podanej w informacji wprowadzającej? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Brak zmiany szybkości reakcji chemicznej pomimo obniżenia temperatury, reguła van't Hoffa. Podręcznik 2.2 zad. 2
Zależność szybkości reakcji chemicznej od temperatury z pewnym przybliżeniem opisuje tzw. reguła van’t Hoffa, którą przedstawia się wzorem:
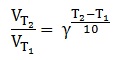
W wyrażeniu tym VT1 oraz VT2 to szybkości reakcji prowadzonych w temperaturach – bazowej (T1) oraz po jej zmianie (T2) – zwiększeniu, bądź zmniejszeniu. Parametr γ to tzw. współczynnik temperaturowy van’t Hoffa, który jest wielkością charakterystyczną dla danej reakcji chemicznej.
Współczynnik temperaturowy van’t Hoffa pewnej biegnącej zgodnie z kinetyką I-rzędu reakcji chemicznej ma wartość równą 2. Przy stężeniu substratu równym 1 mol∙dm–3 początkowa szybkość tej reakcji w temperaturze T1 wynosi 0,15 mol·dm–3·s–1.
Zaproponuj, co należałoby zrobić, aby po obniżeniu temperatury początkowej układu o 20 K, reakcja przebiegła z taką samą szybkością, jak w temperaturze T1, jeśli nie mamy możliwości zastosowania katalizatora? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena, czy wykonanie określonej czynności wpłynie na ilość zanieczyszczeń w mieszaninie poreakcyjnej. Podręcznik 2.2 zad. 3
Produktem reakcji termicznego rozkładu chloranu(V) potasu są dwa związki chemiczne – chloran(VII) potasu oraz chlorek potasu. Jeśli proces ten przeprowadzi się w obecności katalizatora – tlenku manganu(IV), produktami reakcji będą głównie chlorek potasu i tlen. Do 4,96 g chloranu(V) potasu dodano niewielką ilość katalizatora manganowego (MnO2), przy czym nie został on rozprowadzony w próbce w sposób równomierny. Zawartość naczynia prażono do momentu ustalenia się stałej masy.
Oceń, czy równomierne rozproszenie katalizatora w próbce spowoduje wzrost, czy może spadek ilości zanieczyszczeń w postaci chloranu(VII) potasu w mieszaninie poreakcyjnej? Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określanie wpływu wybranych czynników na położenie stanu równowagi reakcji chemicznej (reguła przekory). Podręcznik 2.2 zad. 4
Przebiegającą w fazie gazowej pirolizę metanu opisuje równanie stechiometryczne:
2CH4 ⇄ C2H2 + 3H2 ΔHo = 381 kJ
W jaki sposób przesuwając stan równowagi tej reakcji chemicznej można zwiększyć ilość acetylenu w układzie poprzez zmianę: a) ciśnienia, b) temperatury, c) pojemności naczynia reakcyjnego. Uzasadnij swoje stanowisko. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór probówki, w której reakcja przebiegła z większą szybkością. Podręcznik 2.2 zad. 5
Przygotowano cztery układy reakcyjne, które przedstawia rysunek poniżej:
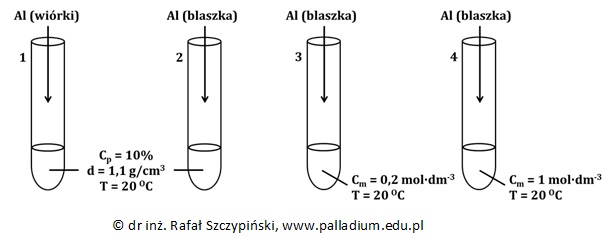
Przed rozpoczęciem doświadczenia, w każdej z probówek znajdowały się wodne roztwory wodorotlenku sodu o takiej samej objętości, równej 5 cm3. Do każdej z probówek wprowadzono próbkę glinu o takiej samej masie, ale w różnej postaci (blaszka lub wiórki).
W której z probówek reakcja przebiegła z większą szybkością? W wykropkowane pola wstaw odpowiedni znak „<” lub „>”. 1 ……………… 2 2 ……………… 3 © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Ocena możliwości szybszego lub wolniejszego przebiegu reakcji chemicznej wraz z uzasadnieniem. Podręcznik 2.2 zad. 6
Przygotowano cztery układy reakcyjne, które przedstawia rysunek poniżej:

Przed rozpoczęciem doświadczenia, w każdej z probówek znajdowały się wodne roztwory wodorotlenku sodu o takiej samej objętości, równej 5 cm3. Do każdej z probówek wprowadzono próbkę glinu o takiej samej masie, ale w różnej postaci (blaszka lub wiórki).
Reakcja glinu z wodnym roztworem wodorotlenku sodu jest procesem egzotermicznym.
Oceń, czy po wprowadzeniu aluminiowej blaszki reakcja ta biegłaby szybciej, czy wolniej w probówce nr 4, gdyby początkowa temperatura roztworu (przed wprowadzeniem glinu) wynosiła 60 ⁰C? Uzasadnij swoją odpowiedź. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rozdział mieszaniny chlorku wapnia z siarką. Podręcznik 3.2 zad. 1. Metody rozdziału mieszanin
Dysponujesz wodą destylowaną oraz niezbędnym szkłem i aparaturą laboratoryjną.
Zaproponuj metodę rozdziału mieszaniny stanowiącej chlorek wapnia oraz siarkę. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rozdział mieszaniny substancji ciekłych na składniki. Podręcznik 3.2 zad. 2. Metody rozdziału mieszanin
W kolbie okrągłodennej znajdowały się zlewki trzech substancji chemicznych: dichlorometanu (Twrz = 40 ⁰C), ortoksylenu (Twrz = 144 ⁰C) oraz heksanu (Twrz = 69 ⁰C).
Dysponując niezbędnym szkłem oraz aparaturą laboratoryjną zaproponuj doświadczenie, którego celem będzie rozdział podanej mieszaniny na poszczególne składniki. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wybór poprawnej kolejności użytych płuczek do gazów podczas oczyszczania metanu. Podręcznik 3.2 zad. 3. Metody rozdziału mieszanin
Metan zanieczyszczony siarkowodorem oraz domieszkami amoniaku oczyszcza się poprzez przepuszczenie opisanej mieszaniny gazów przez zestaw dwóch płuczek, przy czym dany rodzaj zanieczyszczenia usuwany zostaje tylko w jednej płuczce.
Spośród wodnych roztworów podanych związków chemicznych wybierz dwa, które posłużyłyby do usunięcia z opisanej mieszaniny gazów – najpierw amoniaku, a następnie siarkowodoru. Odczynniki: KOH(aq), NaCl(aq), H2SO4(aq). © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Wyodrębnianie miedzi z mieszaniny zawierającej ten metal oraz cynk. Podręcznik 3.2 zad. 4. Metody rozdziału mieszanin
W zlewce znajdowały się wiórki miedziane zanieczyszczone nalotem cynkowym.
Dysponując niezbędną aparaturą oraz szkłem laboratoryjnym zaprojektuj doświadczenie, którego celem będzie uzyskanie możliwie czystej miedzi. Wybierz jeden spośród podanych odczynników HNO3(stęż), MnCl2(aq), HCl(aq): oraz opisz swój tok postępowania. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
