Opis obserwacji dotyczących doświadczenia z wykorzystaniem roztworów zasady sodowej oraz chlorku magnezu
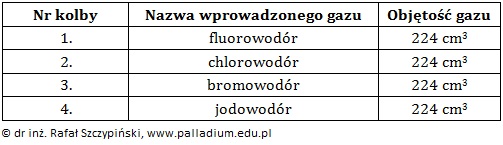
Przeprowadzono doświadczenie chemiczne, którego schemat ilustruje rysunek:
Podczas opisanego doświadczenia do probówek oznaczonych cyframi 1 oraz 3 wprowadzono nadmiar (względem substancji rozpuszczonej) odczynnika i energicznie wstrząśnięto ich zawartością. W jednym z naczyń uzyskano roztwór rzeczywisty.
Napisz, co zaobserwowano w pierwszej probówce w wyniku przeprowadzonego doświadczenia? Odpowiedź uzasadnij równaniem reakcji chemicznej zapisanym w formie jonowej skróconej. Obserwacje: Równanie reakcji chemicznej: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie jak zmieniła się barwa fazy wodnej w wyniku przeprowadzonego doświadczenia z udziałem wodorotlenku wapnia
Przeprowadzono doświadczenie chemiczne, którego schemat ilustruje rysunek:

Podczas opisanego doświadczenia do probówek oznaczonych cyframi 1 oraz 3 wprowadzono nadmiar (względem substancji rozpuszczonej) odczynnika i energicznie wstrząśnięto ich zawartością. W jednym z naczyń uzyskano roztwór rzeczywisty. W wyniku przeprowadzonego eksperymentu z udziałem zawartości probówki nr 2 zaobserwowano zmianę barwy fazy wodnej.
Napisz, na czym ta zmiana polegała? Odpowiedź uzasadnij równaniem chemicznym odpowiedniego procesu oraz podaj jego nazwę. Odpowiedź: Równanie chemiczne procesu: Nazwa procesu: Rozwiązanie tego zadania dostępne jest nieodpłatnie pod poniższym linkiem: © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Zapis obserwacji podczas przebiegu doświadczenia z udziałem tlenku azotu(V)
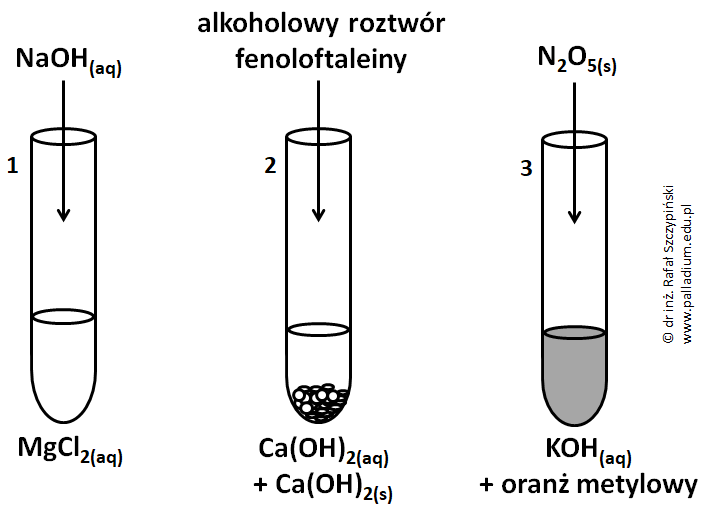
Przeprowadzono doświadczenie chemiczne, którego schemat ilustruje rysunek:

Podczas opisanego doświadczenia do probówek oznaczonych cyframi 1 oraz 3 wprowadzono nadmiar (względem substancji rozpuszczonej) odczynnika i energicznie wstrząśnięto ich zawartością. W jednym z naczyń uzyskano roztwór rzeczywisty.
Napisz, co zaobserwowano w probówce oznaczonej cyfrą 3 podczas przeprowadzenia eksperymentu? © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Reakcja roztworu wodorotlenku baru z wodną zawiesiną tlenku cynku oraz roztworem wodorowęglanu wapnia
W celu przeprowadzenia pewnych doświadczeń chemicznych, przygotowano kilka zestawów trzech odczynników (rysunek poniżej):
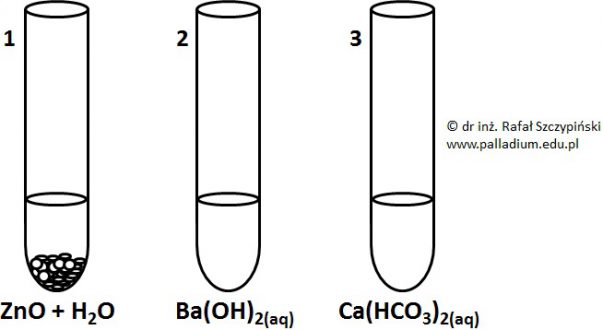
W probówce nr 1 znajdowała się wodna zawiesina tlenku cynku. Zawartość probówek o numerach 2 i 3 stanowiły rozcieńczone roztwory wodne.
Podczas doświadczenia z wykorzystaniem drugiej serii naczyń, zawartość probówki nr 2 przelano do dwóch pozostałych, przy czym zastosowano niewielki nadmiar zawartego w niej odczynnika.
Napisz w formie jonowej skróconej równania reakcji chemicznych, jakie przebiegły w probówkach o numerach 1 i 3 oraz towarzyszące im obserwacje. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Stosunek stechiometryczny pierwiastków w związku chemicznym powstałym w wyniku rozkładu wodorowęglanu wapnia
W celu przeprowadzenia pewnych doświadczeń chemicznych, przygotowano kilka zestawów trzech odczynników (rysunek poniżej):

W probówce nr 1 znajdowała się wodna zawiesina tlenku cynku. Zawartość probówek o numerach 2 i 3 stanowiły rozcieńczone roztwory wodne.
Związek chemiczny, którego roztwór znajdował się w probówce nr 3 umieszczono w tyglu porcelanowym i wyprażono w temperaturze 1000 ⁰C. Po pewnym czasie stwierdzono, że dalsze ogrzewanie nie powoduje zmiany masy zawartości naczynia.
Określ stosunek molowy oraz wagowy drobin wchodzących w skład pozostałego po wyprażeniu ciała stałego. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Rozszyfrowanie wzoru oraz zapis równań reakcji tlenku z roztworem kwasu oraz roztworem zasady wraz z opisem obserwacji
Pewien tlenek metalu w reakcji z wodnym roztworem wodorotlenku sodu daje związek kompleksowy, w którym metal ten przyjmuje liczbę koordynacyjną równą sześć. W stanie podstawowym atomy tego pierwiastka chemicznego mają jeden elektron niesparowany oraz trzy powłoki elektronowe.
Przeprowadzono doświadczenie chemiczne z udziałem opisanego tlenku metalu, umieszczając w dwóch różnych probówkach taką samą jego ilość. Do jednej z nich dodano wodny roztwór wodorotlenku sodu, do drugiej natomiast – kwas solny. Po energicznym wstrząśnięciu zawartością obu naczyń stwierdzono zmiany świadczące o przebiegu reakcji chemicznej.
Napisz w formie jonowej skróconej równania przebiegających w każdej z probówek reakcji chemicznych, w których wykorzystano opisany tlenek metalu, a następnie opisz zmiany, jakie zaobserwowano w wyniku przeprowadzonego eksperymentu. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Określenie charakteru chemicznego tlenku nieznanego metalu podczas doświadczenia z roztworem kwasu oraz roztworem zasady
Pewien tlenek metalu w reakcji z wodnym roztworem wodorotlenku sodu daje związek kompleksowy, w którym metal ten przyjmuje liczbę koordynacyjną równą sześć. W stanie podstawowym atomy tego pierwiastka chemicznego mają jeden elektron niesparowany oraz trzy powłoki elektronowe.
Przeprowadzono doświadczenie chemiczne z udziałem opisanego tlenku metalu, umieszczając w dwóch różnych probówkach taką samą jego ilość. Do jednej z nich dodano wodny roztwór wodorotlenku sodu, do drugiej natomiast – kwas solny. Po energicznym wstrząśnięciu zawartością obu naczyń stwierdzono zmiany świadczące o przebiegu reakcji chemicznej.
Podkreśl właściwe wyrażenie w nawiasie dotyczące charakteru chemicznego opisanego tlenku metalu (kwasowy, zasadowy, amfoteryczny). Uzasadnij swój wybór. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone
Opis obserwacji dotyczących doświadczenia z udziałem roztworu siarczanu(VI) miedzi(II), siarczanu(VI) amonu oraz wodorotlenku sodu
Wodorotlenki trudno rozpuszczalne w wodzie można otrzymać na kilka sposobów. Zwykle są to reakcje przebiegające w wyniku zmieszania wodnych roztworów soli i mocnej zasady lub soli i wody amoniakalnej. W przypadku drugiego z wymienionych procesów wiele otrzymanych w ten sposób wodorotlenków metali bloku d ulega dalszej reakcji z nadmiarem dodawanego odczynnika strącającego, tworząc w ten sposób związki kompleksowe. W jonie kompleksowym atom centralny często przyjmuje liczbę koordynacyjną o wartości dwukrotnie większej od wartości ładunku jonów tego metalu, jaki miał w soli użytej do reakcji.
Przeprowadzono doświadczenie chemiczne, którego schemat zilustrowano poniższym rysunkiem. Podczas wkraplania roztworu NaOH zawartość umieszczonej na mieszadle magnetycznym kolby bardzo ostrożnie ogrzewano.
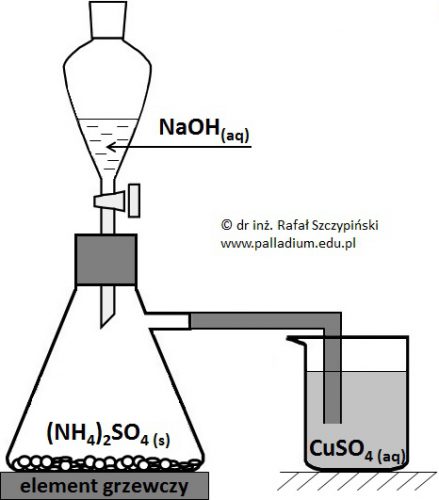
Opisz obserwacje jakie odnotowano w zlewce, jeśli zastosowano nadmiar roztworu wodorotlenku sodu oraz siarczanu(VI) amonu względem siarczanu(VI) miedzi(II). Odpowiedź uzasadnij za pomocą równań odpowiednich reakcji chemicznych, zapisanych w formie jonowej skróconej. © dr inż. Rafał Szczypiński, wszelkie prawa zastrzeżone